
分析 食盐中的碘是以碘酸钾形式存在,计算含碘量是以碘元素进行计算,人体缺碘,易导致甲状腺疾病,根据化合价代数和为0判断元素的化合价,由题中信息可知,碘酸钾易分解,碘单质在四氯化碳的溶解度比在水中的溶解度大的多,从碘水中提取碘单质用萃取操作.
解答 解:(1)人体缺碘,易导致甲状腺疾病,碘是人体内合成甲状腺激素的主要原料,
故答案为:甲状腺;
(2)食盐中的碘是以碘酸钾形式存在,计算含碘量是以碘元素进行计算,碘盐中不存在碘原子和分子,在KIO3中,K的化合价为+1价,O的化合价为-2价,根据化合价代数和为0可知I的化合价为+5价,
故答案为:元素;+5;
(3)烹调时,待食品熟后加入碘盐,说明碘酸钾不稳定,在加热时易分解,
故答案为:分解;
(4)碘单质在四氯化碳的溶解度比在水中的溶解度大的多,可用萃取提取,
故答案为:萃取.
点评 本题考查碘盐知识,题目难度不大,注意把握题给信息,并在学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:实验题
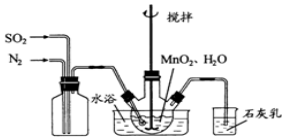
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
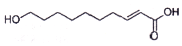 王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )| A. | 含有两种官能团 | |
| B. | 与足里NaOH反应生成Cl0H18O3Na2 | |
| C. | 能发生加成反应,氧化反应、取代反应、加聚反应 | |
| D. | 能使Br/CCl4溶液、酸性KMnO4溶液褪色,褪色原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 氧化镁与稀硫酸混合:MgO+2H+═Mg2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | Br2+2KOH═KBr+KBrO+H2O | |
| C. | 3H2O2+2KCrO2+2KOH═2K2CrO4+4H2O | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾,在550℃时能被氧气氧化 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com