
工业上有一种方法有效地开发利用CO2,是用CO2来生产燃料甲醇。为探究反应原理,进行如下实验,在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g);△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到平衡,氢气的平均反应速率v(CO2)= ________mol/(L•min);
(2)氢气的转化率= ________;
(3)求此温度下该反应的平衡常数K=________;
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________
A.将H2O(g)从体系中分离出去
B.充入He(g),使体系压强增大
C.升高温度
D.再充入1mol CO2和3mol H2
(5)当反应达到平衡时,CO2的物质的量浓度为c1,然后向容器中再加入一定量CO2,待反应再一次达到平衡后,CO2的物质的量浓度为c2,则c1________ c2(填>、<、=)
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源:2015-2016学年辽宁省葫芦岛市六校协作体联考高二下期中化学试卷(解析版) 题型:填空题
A、B、C、D、E为前36号元素,它们的核电荷数依次递增,已知:A是原子半径最小的元素;B原子核外有两个未成对电子,且B是形成化合物种类最多的元素;B、C、D处于同周期,C的第一电离能大于前后相邻元素;D的电负性较大,仅次于氟元素;E是前四周期中未成对电子数最多的元素.
请回答下列问题:
(1)E元素原子的外围电子排布式为 ,C的第一电离能大于其后面相邻元素的原因是 ;
(2)实验测得A2D的蒸气密度比相同条件下理论值明显偏大,分析可能的原因是 .
(3)A、B、C形成的三原子分子中B的杂化轨道类型为 ,该分子中含有的σ键和π键的数目之比为 .
(4)+3价的E形成的八面体配合物ECla•bNH3,若1mol配合物与足量AgNO3溶液作用生成2molAgCl沉淀,则b= .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省南通市如皋市高一下期中化学试卷(解析版) 题型:选择题
在含有大量Ba2+、OH﹣、Cl﹣的溶液中,还可能大量共存的离子是( )
A.HCO3﹣ B.NO3﹣ C.NH D.Al3+
D.Al3+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一下6月月考理科化学试卷(解析版) 题型:选择题
如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
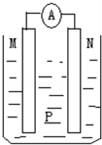
选 项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下6月月考化学试卷(解析版) 题型:填空题
某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号) 。
a.C7H12O2 b.C6H14 c.C6H14O d.C7H14O3
(2)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为 ;
②链烃A与溴的CCl4溶液反应生成B;B与NaOH的醇溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学方程式: ;
③B与足量NaOH水溶液完全反应,生成有机物E,该反应的化学方程式: ;E与乙二醇的关系是 。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3∶2∶1,则A的名称为 。
(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下6月月考化学试卷(解析版) 题型:选择题
4.6g纯净金属钠在干燥空气中被氧化后,得到7.0g固体,由此可判断其氧化产物是
A.只有Na2O B.只有Na2O2 C.Na2O2和Na2O D.无法确定
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二下6月月考化学试卷(解析版) 题型:选择题
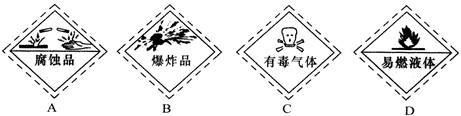
8月12日天津滨海新区的危险品仓库发生爆炸,遇难者上百人。以下是一些常用的危险品标志,装运乙醇的集装箱应贴的图标是( )
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二下期末化学试卷(解析版) 题型:选择题
一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是( )
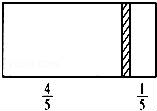
A.右边CO与CO2分子数之比为1:3
B.右侧气体密度是相同条件下氢气密度的18倍
C.右侧CO的质量为1.75g
D.若隔板处于距离右端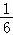 处,其他条件不变,则前后两次压强之比为25:24
处,其他条件不变,则前后两次压强之比为25:24
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二下第三次月考化学试卷(解析版) 题型:选择题
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+═Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol.下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为xmol
D.反应结束后,测得溶液中三种金属离子的总物质的量为ymol,则原Fe3+的总物质的量为(y﹣x)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com