
分析 (1)反应中氯元素化合价+1价变化为-1价,电子转移2e-,铬元素化合价+3价变化为+6价,电子转移3e-,电子转移总数为6e-,结合电子守恒、原子守恒配平书写化学方程式,依据元素化合价变化判断电子转移方向及数目,用双线桥表示电子转移;
(2)元素化合价升高的失电子发生氧化反应,做还原剂,被还原的元素化合价降低.
解答 解:(1)反应中氯元素化合价+1价变化为-1价,电子转移2e-,铬元素化合价+3价变化为+6价,电子转移3e-,电子转移总数为6e-,NaClO、NaCl前系数乘3,硫酸铬前系数为1,Na2CrO4前系数为2,Na2SO4前系数为3,钠守恒得到NaOH前系数为10,氢元素守恒得到H2O前系数为5,得到配平的化学方程式为:
2NaClO+1Cr2(SO4)3+10NaOH=2Na2CrO4+3Na2SO4+3NaCl+5H2O
电子转移总数6e-,双线桥标注电子转移方向和数目得到: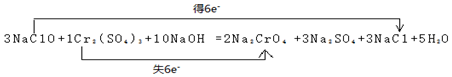
故答案为:2、1、10、2、3、3、5;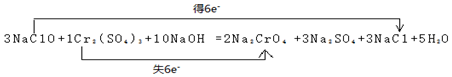 ;
;
(2)2NaClO+1Cr2(SO4)3+10NaOH=2Na2CrO4+3Na2SO4+3NaCl+5H2O,反应中氯元素化合价降低被还原,硫酸铬中个元素化合价升高失电子做还原剂,
故答案为:Cr2(SO4)3; Cl.
点评 本题考查了氧化还原反应方程式书写及表示方法,准确分析反应中元素化合价变化,依据氧化还原反应得失电子数守恒、原子个数守恒规律即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 16.4mol/L | B. | 17.4mol/L | C. | 18.4mol/L | D. | 19.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | W和Y形成的化合物为共价化合物 | |
| B. | Y的最高价氧化物对应的水化物为强酸 | |
| C. | Y的简单气态氢化物的沸点高于X的简单气态氢化物 | |
| D. | 工业上经常采用电解Z的氯化物溶液制备Z单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cl-、Fe3+、K+ | B. | Na+、SO32-、K+、Cl- | ||
| C. | MnO4-、Fe2+、Na+、SO42- | D. | K+、SO42-、HCO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿地可以保持水土,减少水土流失 | |
| B. | 绿地可以调节气候,减少空气中PM2.5含量 | |
| C. | 绿地可以吸收二氧化碳,转化生成氧气 | |
| D. | 为减少园林绿地中病虫害,大量使用杀虫剂解决问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标况下,燃烧1mol S放出的热量为297.23 kJ | |
| B. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量大于297.23 kJ | |
| C. | S ( g )+O2 ( g )=SO2 ( g ) 放出的热量小于297.23 kJ | |
| D. | 形成1 mol SO2 的化学键所释放的总能量大于断裂 1 molS ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 醋酸溶液中加入烧碱溶液:H++OH-═H2O | |
| C. | Ba(OH)2与 H2SO4反应到恰好沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 向澄清的石灰水中滴入少量碳酸氢钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 硫酸氢钠碳酸氢钠溶液中加入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+2H2O | |
| C. | 向氢氧化钠溶液中通入足量CO2+2OH-+CO2?CO32-+H2O | |
| D. | 向氢氧化钡溶液中加入过量硫酸:2H++SO42-+Ba2++2OH-?BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 |
 取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 | 放置一段时间后,生铁片上出现如图所示“斑痕”.其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈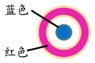 |
| A. | 生铁片发生吸氧腐蚀 | |
| B. | 中心区:Fe-2e-═Fe2+ | |
| C. | 边缘处:O2+2H2O+4e-═4OH- | |
| D. | 交界处:4Fe2++O2+10H2O═4 Fe(OH)3+8H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com