
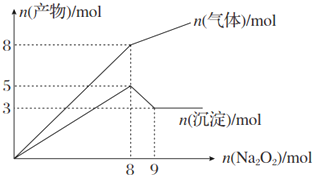
| A. | 2 mol、3 mol、4 mol | B. | 2 mol、3 mol、8 mol | ||
| C. | 3 mol、2 mol、8 mol | D. | 3 mol、2 mol、4 mol |
分析 由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=5mol,沉淀溶解至最小时为氢氧化镁,由图可知n[Mg(OH)2]=3mol,则n[Al(OH)3]=2mol,根据守恒计算n(Al3+)、n(Mg2+);
反应生成的气体为氨气与氧气,由图可知溶液加入8molNa2O2以后,再加Na2O2,气体的增加减少,故加入8molNa2O2时,NH4+完全反应,且沉淀达最大值,故溶液中Mg2+、NH4+、Al3+都恰好完全反应,此时溶液中Mg2+、NH4+、Al3+为Na+代替,溶液中n(Na+)=2n(Na2O2)=2×8mol=16mol,根据电荷守恒有n(Na+)=2n(Mg2+)+n(NH4+)+3n(Al3+),据此计算n(NH4+),据此解答.
解答 解:由图可知,沉淀最大时是氢氧化镁、氢氧化铝沉淀,且n[Mg(OH)2]+n[Al(OH)3]=5mol,沉淀溶解至最小时为氢氧化镁,由图可知n[Mg(OH)2]=3mol,则n[Al(OH)3]=2mol,根据元素守恒可知,n(Al3+)=n[Al(OH)3]=2mol,n(Mg2+)=n[Mg(OH)2]=3mol;
反应生成的气体为氨气与氧气,由图可知溶液加入8molNa2O2以后,再加Na2O2,气体的增加减少,故加入8molNa2O2时,NH4+完全反应,且沉淀达最大值,故溶液中Mg2+、NH4+、Al3+都恰好完全反应,此时溶液中Mg2+、NH4+、Al3+为Na+代替,溶液中n(Na+)=2n(Na2O2)=2×8mol=16mol,根据电荷守恒有n(Na+)=2n(Mg2+)+n(NH4+)+3n(Al3+),即16mol=2×3mol+n(NH4+)+3×2mol,所以n(NH4+)=4mol,
故选A.
点评 本题考查镁铝及其化合物的性质、化学图象计算等,题目难度中等,判断加入8mol过氧化钠时溶液中离子恰好完全反应是解题关键,注意掌握守恒思想的运用.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 铷的金属活动性不如镁强,故镁可置换铷 | |
| B. | 铷的沸点比镁低,把铷蒸气抽出时,平衡右移 | |
| C. | MgCl2的热稳定性不如Rb强 | |
| D. | 铷的单质状态较化合态更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 扩大容器的容积,平衡向正反应方向移动 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 加入水蒸气使容器压强增大,平衡向逆反应方向移动 | |
| D. | 加入固体碳,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O=HCl+HClO | B. | 2Na2O2+2H2O=4NaOH+O2? | ||
| C. | 2F2+2H2O=4HF+O2? | D. | 2Na+4H2O=2NaOH+H2? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜$\stackrel{浓硫酸}{→}$硝酸铜 | B. | 铜$\stackrel{稀硫酸}{→}$硝酸铜 | ||
| C. | Cu$\stackrel{Cl_{2}}{→}$CuCl2$\stackrel{AgNO_{3}}{→}$Cu(NO3)2 | D. | Cu$\stackrel{空气}{→}$CuO$\stackrel{HNO_{3}}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
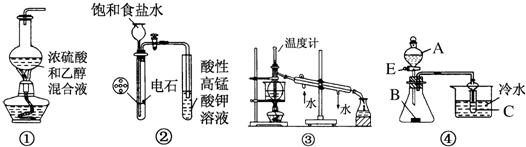
| A. | 图①用于实验室制乙烯 | |
| B. | 图②用于实验室制乙炔并验证乙炔发生氧化反应 | |
| C. | 图③用于实验室中石油的分馏 | |
| D. | 图④中若A为稀硫酸,B为纯碱(固体),C为苯酚钠溶液,则可验证硫酸、碳酸、苯酚酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若V1>V2,则说明HA的酸性比HB的酸性强 | |
| B. | 若V1>V2,则说明HA的酸性比HB的酸性弱 | |
| C. | 因为两种酸溶液的pH相等,故V1一定等于V2 | |
| D. | HA、HB分别和NaOH中和后,所得的溶液都一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3+5 | -2+6 | -1+7 | +2 | +1+2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com