
| A. | LiF | B. | NaF | C. | KF | D. | CsF |
科目:高中化学 来源: 题型:解答题
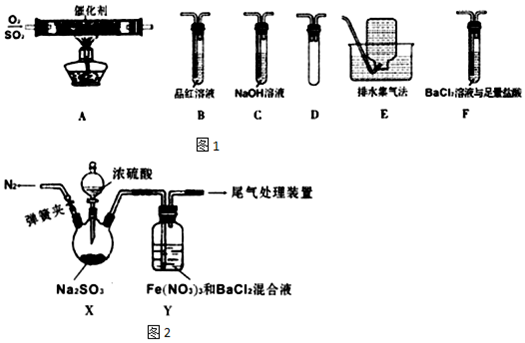
| 实验步骤 | 现象和结论 |
| ①测定Y中混合溶液的pH; ②配制与步骤①有相同pH的稀硝酸与BaCl2的混合液,并通入适量N2; ③将SO2通入步骤②中溶液. | 若出现白色沉淀则假设1成立,若不出现白色沉淀则假设1不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造普通玻璃的主要原料是纯碱、石灰石和石英 | |
| B. | 盛放烧碱溶液的试剂瓶不能用玻璃塞 | |
| C. | 玻璃在加热熔化时有固定的熔点 | |
| D. | 普通玻璃的主要成分是硅酸钠、硅酸钙和二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a电极是该电池的负极,发生氧化反应 | |
| B. | b电极反应式为2NO3-+10e-+12H+═N2↑+6H2O | |
| C. | 电池工作时,H+由左室通过质子交换膜进入右室 | |
| D. | 转化室中发生反应后溶液的pH增大(忽略体积变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
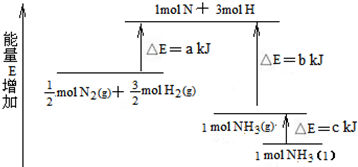
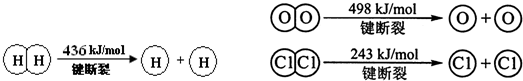
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管未用盐酸润洗就直接注入标准盐酸 | |
| B. | 滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 | |
| C. | 酸式滴定管在滴定前有气泡,滴定后气泡消失 | |
| D. | 读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和石墨互为同分异构体,熔点和硬度都很高 | |
| B. | 12C、13C、14C是碳元素的三种核素,互称为同位素 | |
| C. | 乙醇和二甲醚(CH3-O-CH3)互为同系物 | |
| D. | C4H10的一氯代物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com