

 得到碘酸钾晶体,你建议的方法是蒸发结晶.
得到碘酸钾晶体,你建议的方法是蒸发结晶.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
分析 (1)I2是还原剂被氧化为KH(IO3)2,KClO3是氧化剂被还原为KCl、Cl2,生成两种还原产物所得电子数目相同,I由I2中0价升高到KH(IO3)2中+5价,所以每个I原子失去5个电子,所以1molI2失去10mol电子,即反应转移电子为60mol;
(2)酸性条件下碘酸钾是一种较强的氧化剂,HI具有还原性,但是硝酸不具备;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾,据此来回答;
(4)过滤用到的玻璃仪器有漏斗、烧杯、玻璃棒;
(5)碘酸氢钾在溶液中能完全电离出碘酸根离子、钾离子、氢离子,可以和氢氧化钾发生反应;
(6)根据图表中数据可知碘酸钾的溶解度随温度的变化不大,据此来分析;
解答 解:(1)I2是还原剂被氧化为KH(IO3)2,KClO3是氧化剂被还原为KCl、Cl2,生成两种还原产物所得电子数目相同,反应方程式6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2中,I元素由I2中0价升高到KH(IO3)2中+5价,所以每个I原子失去5个电子,所以1molI2失去10mol电子,所以6molI2完全反应,则该反应中转移电子的数目为60e-,
故答案为:60e-;
(2)步骤中产生氯气,需要将氯气排出反应体系,加入硝酸的目的是制造酸性环境,促进氯气从反应体系中逸出,酸性条件下碘酸钾是一种较强的氧化剂,HI具有还原性,能将已生成的碘酸氢钾还原,所以用硝酸不用氢碘酸,
故答案为:HI具有还原性,能将已生成的碘酸氢钾还原;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气或KClO氧化为高碘酸钾,所以应将氯气排出,
故答案为:Cl2及Cl2与KOH反应生成的KClO,能将KIO3氧化成KIO4;
(4)过滤用到的玻璃仪器有漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃;
(5)碘酸氢钾具有酸性,可以和强碱氢氧化钾发生反应,即KOH+KH(IO3)2=2KIO3+H2O,
故答案为:KOH+KH(IO3)2=2KIO3+H2O;
(6)根据图表可知碘酸钾的溶解度随温度的变化不大,因此,需要用蒸发结晶的方法得到碘酸钾晶体,
故答案为:蒸发结晶.
点评 本题以工业生产碘酸钾为载体,内容涉及方程式配平、对工艺流程的理解评价、方案设计、电解原理等,难度大,是对知识的综合运用和能力的考查.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔点、沸点随核电荷数的增加而增大 | |
| C. | 它们的气态氢化物的热稳定性随核电荷数的增加而减小 | |
| D. | 它们的气态氢化物的还原性随核电荷数的增加而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 用托盘天平准确地称取6.82g食盐 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度可以比水大也可以比水小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现象相同,生成Al(OH)3的量相同 | B. | 现象不同,生成Al(OH)3的量相同 | ||
| C. | 现象相同,生成Al(OH)3的量不同 | D. | 现象不同,生成Al(OH)3的量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
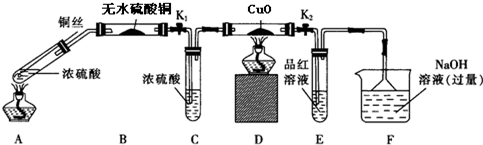

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②⑥ | C. | ③⑤ | D. | ⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收270 kJ热量 | |
| B. | 1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于270 kJ | |
| C. | 相同条件下,1 mol氢气与1 mol氟气的能量总和高于2 mol氟化氢气体的能量 | |
| D. | 2 mol H-F键的键能比1 mol H-H键和1 mol F-F键的键能之和大270 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com