
| A. | 规格 | B. | 温度 | C. | 刻度线 | D. | 物质的量浓度 |
科目:高中化学 来源: 题型:实验题
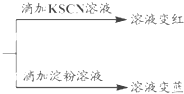
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO和HCl | B. | NH4Cl和HCl | C. | NH4Cl和HClO | D. | NH4Cl和HClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
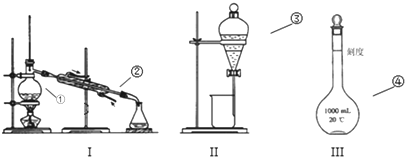
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3•H2O)>K(HCN) | |
| B. | 由水电离出的c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存 | |
| C. | 已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12.向含有Cl-、CrO42-且浓度均为0.010 mol•L-1溶液中逐滴加入0.010 mol•L-1的AgNO3溶液时,CrO42-先产生沉淀 | |
| D. | 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯化钾含有6.02×1023个KCl分子 | |
| B. | 6.02×1024个CO2分子的物质的量是1mol | |
| C. | 1molN2O4含有1molN2分子和4molO原子 | |
| D. | 1molH2分子和1molH2O分子所含的氢原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下22.4L甲醇中含共价键数为5NA | |
| B. | 500ml 1mol/L醋酸溶液中含氧原子数为NA | |
| C. | 28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| D. | 1 mol的羟基与1 moL的氢氧根离子所含电子数均为9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
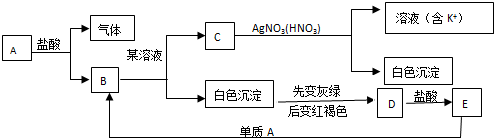
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com