
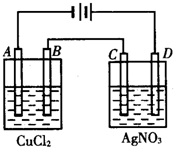
 如图为以惰性电极进行电解.完成下列问题
如图为以惰性电极进行电解.完成下列问题

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)>c(OH-)>c(A-)>c(H+) |
| C、c(Na+)+c(OH-)=c(A-)+c(H+) |
| D、c(Na+)+c(H+)=c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 +HNO3 +HNO3
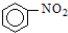 +H2O 取代反应 +H2O 取代反应 | |||
| B、CH2=CH2+Br2→BrCH2CH2Br 加成反应 | |||
C、CH4+Cl2
| |||
D、CH3CH2OH+CH3COOH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 2min后平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应可表示为X+3Y?2Z,其平衡常数为1600 |
| C、改变温度可以改变此反应的平衡常数 |
| D、用Y来表示的该反应的反应速率为0.025 mol?L-1min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2 | B、1:3 |
| C、3:2 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
A、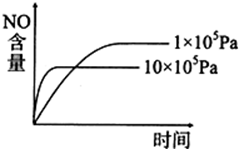 |
B、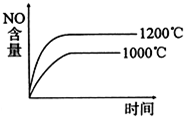 |
| C、NO难溶于水,可以用排水法收集,但不可以用排空气法 |
| D、当生成标准状况下3.36L的氧气时,该反应转移0.6mole |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、O2 |
| B、SO2、SO3 |
| C、SO2、SO3、O2 |
| D、SO3、O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com