
【题目】(1)某学生用标准盐酸滴定待测的NaOH溶液,根据3次实验分别记录有关数据如表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
则依据表中数据,该NaOH溶液的物质的量浓度为______。
(2)实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作可能使测定结果偏低的是______。
A.酸式滴定管用蒸馏水洗涤后未用标准液清洗
B.开始实验时,酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数
D.达到滴定终点时,仰视读数并记录
(3)准确量取25.00mL酸性高锰酸钾溶液应用______。(填仪器名称)
【答案】0.1044mol/L C 酸式滴定管
【解析】
(1)先根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸);
(2)利用c(碱)=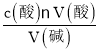 来进行浓度计算;
来进行浓度计算;
(3)高锰酸钾具有氧化性,所以准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管。
(1)由三次盐酸溶液的体积可知,第2组数据偏差太大,要舍去,求出1、3组平均消耗盐酸平均体积值V(盐酸)=![]() mL=26.10mL,由HCl与NaOH反应方程式HCl+NaOH=NaCl+H2O,可知c(碱)=
mL=26.10mL,由HCl与NaOH反应方程式HCl+NaOH=NaCl+H2O,可知c(碱)=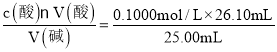 =0.1044mol/L;
=0.1044mol/L;
(2)由c(碱)=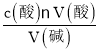 可知:
可知:
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸,消耗酸的体积增大,则c(碱)偏大,A不符合题意;
B.酸式滴定管在滴定前有气泡,滴定后气泡消失,消耗酸的体积增大,则c(碱)偏大,B不符合题意;
C.滴定过程中,锥形瓶内溶液颜色由黄色变为橙色,但又立即变为黄色,此时便停止滴定,记录读数,实际上加入的标准液体积偏小,导致待测碱液浓度偏低,C符合题意;
D.读取盐酸体积时,仰视读数记录,读数偏大,则消耗酸的体积偏大,导致待测液溶液c(碱)偏高,D不符合题意;
故合理选项是C;
(3)酸性高锰酸钾溶液具有强的氧化性,容易腐蚀碱式滴定管的橡胶管,所以准确量取25.00mL酸性高锰酸钾溶液应用酸式滴定管。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种元素的部分信息如下表所示。
元素 | X | Y | Z | W |
相关 信息 | 短周期元素,最高化合价为+7价 | 基态原子中,电子占据的最高能层符号为L,最高能级上只有两个自旋方向相同的电子 | 核外电子共有15种运动状态 | 能与X形成两种常见化合物WX2、WX3,酚遇WX3溶液能发生显色反应 |
回答下列问题:
(1)W的基态原子电子排布式为___,X、Y、Z三种元素电负性由大到小的顺序为___(用具体的元素符号填写)。
(2)化合物YX4、ZX3、ZX5(气态或液态时)中,中心原子的轨道类型不是sp3杂化的是___ (填化学式,下同),分子构型是正四面体的是___,ZX3属于___(极性分子、非极性分子)。
(3)已知WX3的熔点:306℃,沸点:319℃,则WX3的晶体类型为___。
(4)Z原子的价电子轨道表示式为___。
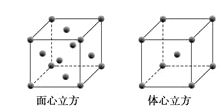
(5)W元素的单质晶体在不同温度下有两种堆积方式,晶胞分别如图所示。在面心立方晶胞中W原子的配位数为___;若W的原子半径为rcm,阿伏加德罗常数为NA,则其体心立方晶体的密度可表示为___gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是( )
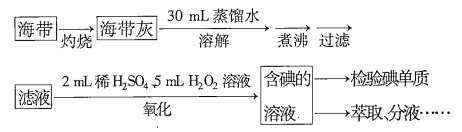
A.灼烧过程中使用的玻璃仪器有酒精灯、烧杯、玻璃棒
B.氧化过程中发生反应的离子方程式为![]()
C.检验碘单质时,可选用淀粉,若淀粉变蓝说明海带中一定含有碘单质
D.分液时,先打开活塞放出下层液体,再关闭活塞,从上口倒出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的p能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
(1)W的基态原子的外围电子排布图为__,其基态原子有__种能量不同的电子。
(2)R的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是__。
(3)ZM3-空间构型为___,其中Z的杂化方式为__。
(4)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为___;与YM分子互为等电子体的离子的化学式为___。
(5)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A、B所示:图B中原子堆积方式为___,A、B中W原子的配位数之比为___。A、B晶胞的棱长分别为acm和bcm,则A、B两种晶体的密度之比为___。

(6)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X).则该合金的化学式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物F和高分子N的合成路线如图所示:
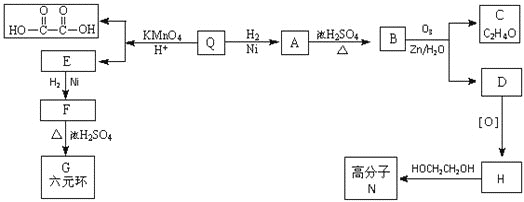
已知:RCH=CHR'![]() RCOOH+R'COOH,RCH=CHR'
RCOOH+R'COOH,RCH=CHR'![]() RCHO+R'CHO
RCHO+R'CHO
![]() 只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为
只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为![]() ,经测定Q的相对分子质量是128。
,经测定Q的相对分子质量是128。![]() 可与
可与![]() 加成,并能与
加成,并能与![]() 恰好完全反应,且分子中无支链。Q的分子式是 ______________。
恰好完全反应,且分子中无支链。Q的分子式是 ______________。
![]() 所含官能团的名称是 ___________、 _____________;
所含官能团的名称是 ___________、 _____________;![]() 的反应类型是 ________________;
的反应类型是 ________________;
![]() 写出C与银氨溶液反应的化学方程式: _______________;
写出C与银氨溶液反应的化学方程式: _______________;
![]() 的结构简式是 _______________;Q的反式结构简式是 ____________。
的结构简式是 _______________;Q的反式结构简式是 ____________。
![]() 下列说法正确的是 _________________。
下列说法正确的是 _________________。
A. C能与苯酚在一定条件下生成高分子化合物
B. D催化加氢的产物与F互为同分异构体
C. F能发生氧化反应、取代反应、加成反应
D. 高分子N的每条分子链中含有![]() 个酯基
个酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是( )
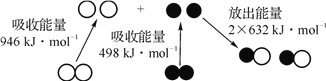
A. 放电条件下,N2(g)和O2(g)混合能直接化合生成NO(g)
B. NO是一种酸性氧化物,能用NaOH溶液处理含NO的尾气
C. N2(g)和O2(g)反应生成 NO(g),相当于N2(g)在O2(g)燃烧,该反应放热
D. 28 g N2(g)和32 g O2(g)完全反应生成 NO(g),放出的能量为180 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机物间的转化关系如图所示(以下变化中,某些反应条件及产物未标明)。A是天然有机高分子化合物,D是一种重要的化工原料。在相同条件下,G蒸气密度是氢气的44倍。
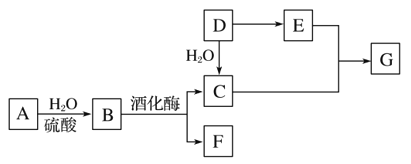
(1)D中官能团的名称:______________________________________。
(2)C和E反应的化学方程式:________________________。
(3)检验A转化过程中有B生成,先中和水解液,再需要加入的试剂是________________________________。
(4)某烃X的相对分子质量是D、F之和,分子中碳与氢的质量之比是5∶1。下列说法正确的是________(填字母)。
A.X 不溶于水,与甲烷互为同系物
B.X性质稳定,高温下不会分解
C.X不存在含有3个甲基的同分异构体
D.X可能和溴水发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2催化加氢制取甲醇、乙醇等低碳醇的研究,对于环境问题和能源问题都具有非常重要的意义。已知一定条件下的如下反应:
CO2(g) + 3H2(g) ![]() CH3OH(g) + H2O(g) H =-49.0 kJ· mol-1
CH3OH(g) + H2O(g) H =-49.0 kJ· mol-1
2CO2(g) + 6H2(g) ![]() CH3CH2OH(g) + 3H2O(g) H=-173.6 kJ· mol-1
CH3CH2OH(g) + 3H2O(g) H=-173.6 kJ· mol-1
下列说法不正确的是
A.CH3OH(g) + CO2(g) + 3H2(g) ![]() CH3CH2OH(g) + 2H2O(g) H<0
CH3CH2OH(g) + 2H2O(g) H<0
B.增大压强,有利于反应向生成低碳醇的方向移动,平衡常数增大
C.升高温度,可以加快生成低碳醇的速率,但反应限度降低
D.增大氢气浓度可以提高二氧化碳的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.硬脂酸甘油酯在烧碱条件下发生水解反应,得到的硬脂酸是肥皂的主要成分
B.检验淀粉在稀硫酸催化条件下是否水解的方法是:取适量水解液于试管中,加入少量新制![]() 悬浊液,加热,观察是否有砖红色沉淀
悬浊液,加热,观察是否有砖红色沉淀
C.向鸡蛋清溶液中加入浓NaOH溶液,可使蛋白质发生变性,从而失去生理功能
D.氨基酸分子中含羧基和氨基原子团,是高分子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com