
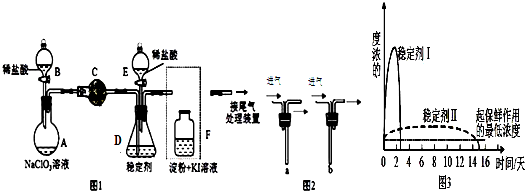
分析 (1)根据仪器特征,可知仪器C是球形干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气;
(2)根据电子转移守恒和原子守恒书写氯酸钠和稀盐酸混和产生Cl2和ClO2的反应化学方程式,为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,说明Cl2被吸收;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
解答 解:(1)根据仪器特征,可知仪器C是球形干燥管;F装置应是Cl2和KI反应,还需要连接尾气处理装置,所以应长管进气,短管出气,故选b,
故答案为:锥形瓶;b;
(2)氯酸钠和稀盐酸混和产生Cl2和ClO2,NaClO3中氯为+5价被还原成ClO2中+4价,盐酸中氯为-1价,被氧化成0价氯,转移电子数为2,所以NaClO3、ClO2前系数为2,Cl2前系数为1,反应化学方程式:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O,:为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故滴加稀盐酸的速度要慢,即调节分液漏斗B的旋塞,减缓(慢)稀盐酸滴加速度,
故答案为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;调节分液漏斗B的旋塞,减缓(慢)稀盐酸滴加速度;
(3)F装置中发生Cl2+2KI=2KCl+I2时,碘遇淀粉变蓝,而F中溶液的颜色不变,则装置C的作用是吸收Cl2,
故答案为:吸收Cl2;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;检验是否有ClO2生成;
(5)由图可知,稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ好,
故答案为:稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度.
点评 本题以ClO2的制备、吸收、释放为载体,考查实验制备方案设计、基本操作、对装置及操作的分析评价等,注意根据问题进行制备流程分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
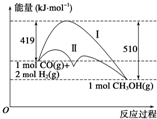 利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)?CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 该反应的△H=+91 kJ•mol-1 | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量小于生成物的总能量 | |
| D. | 如果该反应生成液态CH3OH,则△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其他玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25mol | B. | 0.125mol | C. | 0.1mol | D. | 0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与水蒸气反应的产物是黑色的Fe2O3 | |
| B. | 红热的铁能与水蒸气反应,放出的气体点燃时能发出爆鸣声 | |
| C. | 铁与水蒸气的反应是氧化还原反应 | |
| D. | 常温下,Fe与H2O不反应,但在空气中的O2、H2O共同作用下能发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com