
【题目】金属铝分别和O2、O3发生反应生成Al2O3,反应过程和能量关系如图所示(图中的ΔH表示生成1mol生成物的数据)。下列有关说法中不正确的是( )
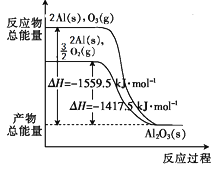
A.Al(s)与O3(g)反应生成Al2O3(s)的热化学方程式为2Al(s)+O3(g)=Al2O3(s);ΔH= -1559.5kJ·mol-1
B.等质量的O2比O3的能量低
C.1mol O2完全转化为O3,需吸收142kJ的热量
D.给3O2(g)![]() 2O3(g)的平衡体系加热,有利于O3的生成
2O3(g)的平衡体系加热,有利于O3的生成
【答案】C
【解析】
由图象可知Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)=Al2O3(s);△H= -1559.5kJmol-1,Al(s)与O2(g)反应的热化学方程式为4Al(s)+3O2(g)=2Al2O3(s);△H=-2835kJmol-1,由此可得3O2(g)=2O3(g);△H=(-2835kJmol-1)-2×(-1559.5kJmol-1)=+284kJmol-1,以此解答该题。
A. 由反应物与生成物的总能量可知Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)=Al2O3(s);△H= -1559.5kJmol-1,故A正确;
B. 3O2(g)=2O3(g);△H=(-2835kJmol-1)-2×(-1559.5kJmol-1)= +284kJmol-1,为吸热反应,则等质量的O2比O3的能量低,O2比O3稳定,故B正确;
C. 3O2(g)=2O3(g);△H=(-2835kJmol-1)-2×(-1559.5kJmol-1)= +284kJmol-1,1 mol O2完全转化为O3,需吸收94.7kJ的热量,故C错误;
D. 1 mol O2完全转化为O3吸收热量,则升高温度,3O2(g)2O3(g)的平衡正向移动,故D正确;
故选C。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
【题目】下列有关金属的工业制法中正确的是( )
A. 制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛
B. 炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物
C. 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D. 炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,1L密闭容器中通入H2和I2各0.016 mol,发生如下反应:H2(g)+I2(g)2HI(g),一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.012 | 0.011 | 0.01 | 0.01 |
请回答:(1)2min内,v(H2) =______mol/(L·min)。
(2)下列能证明该反应已经达到平衡的是______(填字母)。
a.V正(H2)=V逆(HI)
b.混合气体的颜色不再发生变化
c.混合气体中各组分的物质的量不再发生变化
d.混合气体的密度不再变化
(3)该温度下反应的化学平衡常数数值是______。
(4)H2的平衡转化率是______。
(5)温度降低时,该反应的平衡常数变大,则正反应是______(填“放热”或“吸热”)反应。
(6)一定可以提高平衡体系中HI百分含量的措施是____(填字母)。
a.降低温度 b.增大H2浓度 c.加入催化剂 d.降低压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出![]() 中官能团的名称为_________________;
中官能团的名称为_________________;
(2)![]() 的分子式为_____________,1 mol该有机物完全燃烧需消耗氧气的物质的量为________mol,分子中一定共面的原子有________个;
的分子式为_____________,1 mol该有机物完全燃烧需消耗氧气的物质的量为________mol,分子中一定共面的原子有________个;
(3)有机物M(![]() )为苯的同分异构体,M的二氯代物的同分异构体有____种;
)为苯的同分异构体,M的二氯代物的同分异构体有____种;
(4)用系统命名法对下列有机物进行命名:
① CH3C(CH3)=CHCH3:______________;
② CH3CH(CH2CH3)CH(CH3)CH2CH3:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:![]()
![]()
(1)下表所列数据是该反应在不同温度下的化学平衡常数![]()
温度 | 250℃ | 300℃ | 350℃ |
K |
|
|
|
①该反应的平衡常数表达式![]() ______________,
______________,![]() __________
__________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
②某温度下,将![]() 和
和![]() 充入2L的密闭容器中,充分反应10min后,达到平衡时测得
充入2L的密闭容器中,充分反应10min后,达到平衡时测得![]() ,则CO的转化率为____________,此时的温度为_________。
,则CO的转化率为____________,此时的温度为_________。
(2)向![]() 的
的![]() 溶液中加入
溶液中加入![]() 的盐酸,生成沉淀。已知该温度下AgCl的
的盐酸,生成沉淀。已知该温度下AgCl的![]() ,忽略溶液的体积变化,请计算:
,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中![]() ________。
________。
②完全沉淀后,溶液的![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1[
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,
则CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.3kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:2A(g)+2B(g) ![]() C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率υ正增大、D的物质的量浓度c(D)增大的是( )
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率υ正增大、D的物质的量浓度c(D)增大的是( )
A. 缩小容积,增大压强B. 扩大容积,减小压强
C. 移走少量CD. 容积不变,充入“惰性”气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 红棕色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是

A. 该反应的△H>0
B. C点对应状态的平衡常数K(C)=103.638
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30℃时,B点对应状态的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com