
 ,B中所含的化学键有离子键、共价键.又知X溶液显碱性,其原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
,B中所含的化学键有离子键、共价键.又知X溶液显碱性,其原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.分析 (1)A是黄绿色气体,则A是氯气,B组成的阴、阳离子电子数均为10,且焰色反应为黄色,说明B中含有钠元素,A和B反应生成水,说明B中含有氢原子,且B的阴离子电子数为10,所以其阴离子是氢氧根离子,所以B是NaOH,氯气和氢氧化钠反应生成氯化钠和次氯酸钠、水,X的溶液呈碱性,为NaClO,Y为NaCl;
(2)若A为酒精,B为黑色固体,X为红色金属单质,则X是Cu,B为CuO,Y为CH3CHO;
(3)A为Fe(NO3)2,B是HNO3,Y是NO,X是Fe(NO3)3.
解答 解:(1)A是黄绿色气体,则A是氯气,B组成的阴、阳离子电子数均为10,且焰色反应为黄色,说明B中含有钠元素,A和B反应生成水,说明B中含有氢原子,且B的阴离子电子数为10,所以其阴离子是氢氧根离子,所以B是NaOH,氯气和氢氧化钠反应生成氯化钠和次氯酸钠、水,X的溶液呈碱性,为NaClO,Y为NaCl;
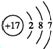
A为氯气,氯原子核外有17个电子、3个电子层,最外层电子数是7,其原子结构示意图为 ,B是氢氧化钠,氢氧化钠中钠离子和氢氧根离子之间存在离子键和共价键,次氯酸钠是强碱弱酸盐,次氯酸根离子易水解而使其溶液呈碱性,水解方程式为ClO-+H2O?HClO+OH-,
,B是氢氧化钠,氢氧化钠中钠离子和氢氧根离子之间存在离子键和共价键,次氯酸钠是强碱弱酸盐,次氯酸根离子易水解而使其溶液呈碱性,水解方程式为ClO-+H2O?HClO+OH-,
故答案为: ;离子键、共价键;ClO-+H2O?HClO+OH-;
;离子键、共价键;ClO-+H2O?HClO+OH-;
(2)若A为酒精,B为黑色固体,X为红色金属单质,则X是Cu,B为CuO,Y为CH3CHO,从结构上看,CH3OCH3与乙醇的关系是同分异构体,
故答案为:CH3CHO;同分异构体;
(3)A为Fe(NO3)2,B是HNO3,Y是NO,X是Fe(NO3)3;
①硝酸具有强氧化性,能氧化硝酸亚铁生成硝酸铁,同时生成一氧化氮,反应方程式为3Fe(NO3)2+4HNO3═3Fe(NO3)3+NO↑+2H2O,
故答案为:3Fe(NO3)2+4HNO3═3Fe(NO3)3+NO↑+2H2O;
②根据转移电子相等计算被还原的硝酸的物质的量,被还原的硝酸的物质的量=$\frac{1mol(3-2)}{5-2}$×63g/mol=21g,
故答案为:21.
点评 本题以物质推断为载体考查了氧化还原反应、盐类水解、溶度积常数等知识点,正确推断物质是解本题关键,根据物质的性质、结构来分析解答,难点是被还原硝酸质量的计算,根据转移电子守恒计算即可,难度中等.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2、Fe、HCl | B. | NaOH、液态O2、碘酒 | ||
| C. | 生石灰、白磷、熟石灰 | D. | 空气、氮气、硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
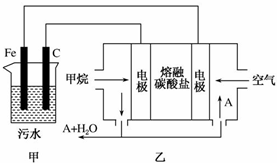 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.某科研小组用该原理处理污水,设计的装置如图所示.下列说法正确的是( )| A. | 为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液 | |
| B. | 甲装置中Fe电极的反应为Fe-3e-═Fe3+ | |
| C. | 为了使燃料电池乙长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| D. | 当乙装置中有1.6 gCH4参加反应时,C电极理论上生成气体的体积在标况下为4.48 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚕丝和棉花的组成元素相同,结构不同,因而性质不同 | |
| B. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| C. | 古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 | |
| D. | 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 必为第1层 | B. | 只能是第2层 | C. | 只能是第3层 | D. | 可以是任意层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LNH3中含有的氢原子数为3NA | |
| B. | 标准状况下,足量Na2O2和11.2LCO2反应,转移电子数目为NA | |
| C. | 常温常压下,16g CH4中所含中子数为10NA | |
| D. | 常温常压下,2.8g乙烯中含有碳氢键的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
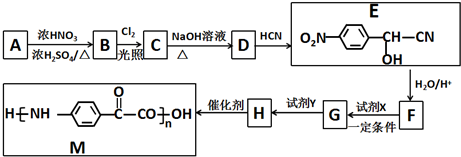
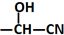 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$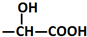
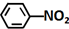 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$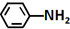 (-NH2易被氧化)
(-NH2易被氧化)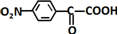 .
.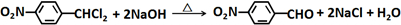 .
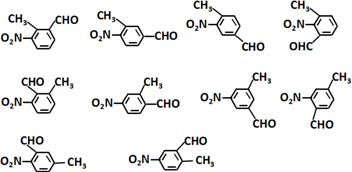
.
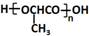 的合成路线:
的合成路线: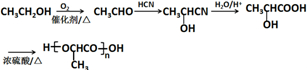 .(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.
.(无机试剂任选)合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH2=CH2$→_{催化剂/△}^{HCl}$CH3CH2Cl.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 青铜、不锈钢和硬铝都是合金 | |
| B. | 铝可用于制造燃烧弹和信号弹 | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用,因此铝罐可久盛食醋 | |
| D. | 铜锈的主要成分是Cu2(OH)2CO3,可以用稀盐酸除铜锈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com