
【题目】向仅含SO32-、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )

A.曲线Ⅱ代表Br-的变化情况
B.曲线Ⅰ对应的反应:SO32-+Cl2+H2O=2H++SO42-+2Cl-
C.通入的氯气为5 mol时,溶液中的主要阴离子为Cl-、SO32-
D.溶液中n(Na+)=n(SO32-)+n(I-)+n(Br-)
【答案】B
【解析】
向仅含SO32-、I-、Br-的溶液中通入适量氯气,还原性为SO32->I->Br-,首先发生反应H2O+SO32-+Cl2=SO42-+2Cl-+2H+,图中曲线I表示SO32-变化,然后发生2I-+Cl2=I2+2Cl-,故曲线II表示I-的变化,最后发生2Br-+Cl2=Br2+2Cl-,曲线III表示Br-的变化;
A.由上述分析可知,曲线II表示I-的变化,故A错误;
B.由还原性的强弱可知,曲线Ⅰ对应的反应:SO32-+Cl2+H2O═2H++SO42-+2Cl-,故B正确;
C.由图可知,通入的氯气为1 mol时,溶液中不存在SO32-,故C错误;
D.由电荷守恒可知,溶液中n(Na+)=2n(SO32-)+n(I-)+n(Br-),故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】今年6月比亚迪正式发布刀片电池,大幅度提高了电动汽车的续航里程可媲美特斯拉,刀片电池采用磷酸铁锂技术。可利用钛铁矿[主要成分为FeTiO3(难溶性亚铁盐),还含有少量MgO等杂质]来制备LiFePO4和Li4Ti5O12等锂离子电池的电极材料,工艺流程如图:
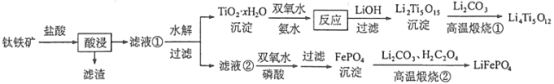
回答下列问题:
(1)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式 _______。
(2)TiO2xH2O沉淀与双氧水、氨水“反应”转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示:
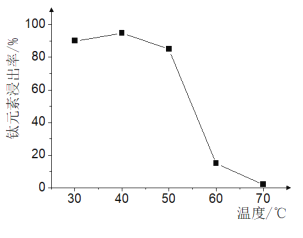
反应温度过高时,Ti元素浸出率变化的原因是 ________。
(3)“滤液②”中含有的金属离子是 _______;加入双氧水和磷酸使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时溶液中 c(PO43-)=________。(FePO4的 Ksp=1.3×10 -22)
(4)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式______。
(5)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为_____。
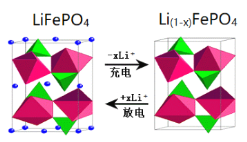
(6)作为刀片电池正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,则正极电极反应式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中。纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是
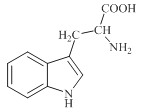
A.色氨酸的分子式为C11H12N2O2
B.色氨酸能发生取代、加成、酯化、中和反应
C.色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐
D.将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①H2(g)+![]() O2(g)= H2O(l) △H= —285.8 kJ/mol
O2(g)= H2O(l) △H= —285.8 kJ/mol
②H2(g)+![]() O2(g)= H2O(g) △H= —241.8kJ/mol
O2(g)= H2O(g) △H= —241.8kJ/mol
③C(s)+![]() O2 (g) = CO (g) △H= —110.5kJ/mol
O2 (g) = CO (g) △H= —110.5kJ/mol
④C(s)+ O2 (g) = CO2 (g) △H= —393.5kJ/mol
回答下列问题:
上述反应中属于放热的是_________;H2的燃烧热为________;C的燃烧热为_____;
(2)汽油的重要成分是辛烷(C8H18),1 mol C8H18(l)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518 kJ热量。请写出此反应的热化学方程式___________
(3)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化成液态水时放热2.444kJ,试写出氢气的燃烧热的热化学方程式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表各组物质(或者它们的溶液)通过一步反应可实现如图所示的转化的是
选项 | X | Y | Z |
|
A | Si | Na2SiO3 | H2SiO3 | |
B | S | H2S | SO2 | |
C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
D | Mg(OH)2 | MgCO3 | MgCl2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生成氮肥的原料。回答下列问题:
(1)氮气的电子式________________ ,氨的结构式__________________;
(2)氨水显碱性,写出氨水的电离方程式___________________________________________;
(3)氨催化氧化生成NO是工业制硝酸的反应之一,写出该反应的化学方程式:________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的回收利用对温室气体的减排具有重要的意义。在2L密闭容器中,加入2.00molCO2和2.0 mol H2以及催化剂发生反应:CO2(g)+H2 (g)![]() HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
HCOOH(g) ΔH,测得,n(H2)/mol在不同温度随时间的变化如下表:
60 min | 90 min | 120 min | 150 min | 180 min | ||
实验I | Tl/K | 1.50 mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
实验Ⅱ | T2/K | 1.45 mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)比较实验温度T1___T2(填“>”、“<”),该反应的ΔH___0(填“>”、“=”、“<”)。
(2)实验I中0~60 min内用HCOOH表示的该反应的平均反应速率为_____。
(3)实验Ⅱ反应开始时体系压强为P0,第90min时体系压强为Pl,则Pl∶P0=___。
(4)比较实验I、Ⅱ在80min时的逆反应速率大小vl___vⅡ(填“>”、“<”或“无法判断”),原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各装置不能达到实验目的是
A.利用①吸收多余的氨气
B.装置②可用于除去Cl2中的HCl
C.装置③可用于干燥氨气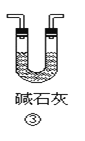
D.装置④可用于排空气法收集H2、CO2、Cl2、HCl等气体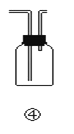
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:m A(g)+n B(g)![]() x C(g) ΔH=Q kJ/mol ,在密闭容器中进行下图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
x C(g) ΔH=Q kJ/mol ,在密闭容器中进行下图表示反应在不同时间t ,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则
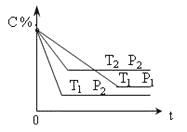
A.T1>T2 ,P1>P2 ,m+n>x,Q>0
B.T1<T2 ,P1<P2 ,m+n<x,Q<0
C.T1>T2 ,P1<P2 ,m+n<x,Q<0
D.T1<T2 ,P1>P2 ,m+n>x,Q<0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com