
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
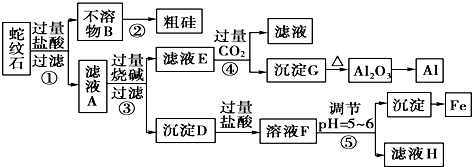
分析 蛇纹石矿加盐酸溶解,发生反应的化学方程式为MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O,SiO2不与盐酸反应,以固体形式先除去,因此,不溶物B为SiO2,滤液A中除了Mg2+外,还有的金属离子是Al3+和Fe3+,加入过量烧碱,滤液E为偏铝酸钠溶液,通入过量二氧化碳反应生成氢氧化铝沉淀,加热分解生成氧化铝,用电解法冶炼可生成铝;沉淀D为Fe(OH)3和Mg(OH)2,加入过量盐酸生成氯化铁和氯化铝,调节溶液pH=5~6时,促进铁离子水解,生成氢氧化铁沉淀,滤液H为氯化镁溶液,在HCl氛围中加热、蒸发结晶可得MgCl2•6H2O,脱水生成MgCl2,电解可得Mg,以此解答该题.
解答 解:(1)蛇纹石加过量盐酸溶解,MgO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去,所以滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+,
故答案为:Fe3+、Al3+、Mg2+、H+;
(2)偏铝酸根离子和二氧化碳反应生成氢氧化铝和碳酸氢根离子,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)氢氧化铝加入分解生成氧化铝,反应的方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,故答案为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(4)操作⑤中加入的物质能和盐酸反应,且不引进新的杂质,氧化镁、氢氧化镁难溶于水,但能与酸反应,可起调节pH作用,
故答案为:c;
(5)镁是活泼金属,应采用电解其熔融盐的方法冶炼,所以工业上用电解熔融氯化镁的方法冶炼镁,反应方程式为:MgCl2 $\frac{\underline{\;通电\;}}{\;}$ Mg+Cl2↑,
故答案为:电解.
点评 本题物质的制备,为高考常见题型,侧重于学生的分析能力和实验能力的考查,题目涉及元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加MgSO4 | B. | 加HCl溶液 | C. | 加NaOH | D. | 加少量水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 煅烧温度(℃) | 煅烧时间(h) |
| ① | 550 | 2 |
| ② | 600 | 1 |
| ③ | 650 | 2 |
| ④ | 700 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示,在大试管里加入3mL乙醇、2mL冰醋酸,再缓缓加入2mL浓硫酸,边加边振荡.在另一支试管中加入饱和碳酸钠溶液用来吸收反应生成物.
如图所示,在大试管里加入3mL乙醇、2mL冰醋酸,再缓缓加入2mL浓硫酸,边加边振荡.在另一支试管中加入饱和碳酸钠溶液用来吸收反应生成物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使淀粉-KI试纸显蓝色的溶液中:K+、H+、SO42-、I- | |
| B. | 能溶解CaCO3的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | 在酸性KMnO4溶液中:Na+、C2H5OH、NH4+、Cl- | |
| D. | 澄清透明的溶液中:Cu2+、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把金属铁放入稀硫酸中:Fe+2H+═Fe3++H2↑ | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氢氧化铜加到盐酸中:Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═Ba SO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com