
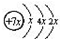 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了构造原理、泡利原理和洪特规则.
,这样排布遵循了构造原理、泡利原理和洪特规则. 分析 A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,则C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
解答 解:A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期第一电离能最小的元素,故B为Na元素,C的最外层有三个成单电子,则C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,E的核外电子排布式为1s22s22p63s23p63d64s2,则E为Fe元素.
(1)由上述分析可知,A为Si,B为Na元素,
故答案为:Si;Na;
(2)元素的非金属性越强,则最高价氧化物对应水化物酸性越强,则酸性最强的是HNO3,
故答案为:HNO3;
(3)D所在周期为第二周期,同周期中稀有气体原子为稳定结构,第一电离能最大,故第一电离能最大的元素是Ne,
故答案为:Ne;
(4)D的氢化物为NH3,C的氢化物为PH3,因为氨气分子间能形成氢键,使氨气的沸点升高,沸点高于PH3的,
故答案为:高;NH3分子间形成氢键;
(4)E为Fe元素,原子序数为26,位于周期表第四周期Ⅷ族,位于d区,
故答案为:26;Ⅷ;d;
(5)B、C最高价氧化物分别为Na2O、P2O5晶体类型分别是离子晶体、分子晶体,故答案为:离子;分子;
(6)D是N元素,原子核外有7个电子,1s、2s、2p能级上分别排列2、2、3个电子,所以其核外电子排布图为: ,这样排布遵循了构造原理、泡利原理、洪特规则,
,这样排布遵循了构造原理、泡利原理、洪特规则,
故答案为: ;泡利;洪特.
;泡利;洪特.
点评 本题考查元素推断、元素周期律、核外电子排布规律、氢键等,推断元素是解题的关键,熟练掌握元素周期律,注意同周期主族元素中第一电离能异常情况.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
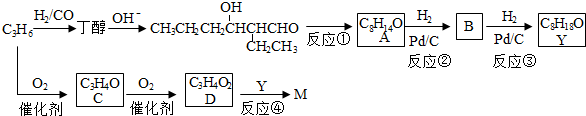
 所需试剂为银氨溶液,酸.
所需试剂为银氨溶液,酸.
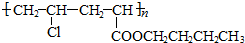
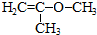 等
等查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0、△S<0 | B. | △H<0、△S>0 | C. | △H>0、△S>0 | D. | △H<0、△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏,石油的裂化和裂解均属于化学变化 | |
| B. | 利用铝热反应可以冶炼Fe、Cr、Mn、W、Na等金属 | |
| C. | 甲烷和氯气制备一氯甲烷的原子利用率可达100% | |
| D. | SO2、NO2、CO2均是导致酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7.0的降水通常称为酸雨 | |
| B. | 燃煤时加入适量石灰石,可减少废气中SO2的量 | |
| C. | 新制氯水经光照一段时间pH增大 | |
| D. | 测定氯水的pH应用干燥的pH试纸,不能用蒸馏水润湿 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Al<Mg<F | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是氧化产物 | |
| B. | KClO3在反应中发生还原反应 | |
| C. | 生成5.6LCO2,转移的电子数目为0.25NA | |
| D. | 24.5g KClO3参加反应,转移电子物质的量为0.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com