
【题目】已知⑴H2O(g) = H2O(l) ΔH1=-Q1 kJ·mol-1
⑵CH3OH(g) = CH3OH(l) △H2=-Q2 kJ·mol-1
⑶2CH3OH(g) +3O2(g) = 2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1
(Q1、Q2、Q3均大于0)若要使1mol液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
A.Q1+ Q2 + Q3
B.0.5Q3-Q2+2Q1
C.Q3-2Q2+4Q1
D.0.5(Q1+Q2+Q3)
【答案】B
【解析】已知(1)H2O(g) = H2O(l) ΔH1=-Q1 kJ·mol-1
⑵CH3OH(g) = CH3OH(l) △H2=-Q2 kJ·mol-1
⑶2CH3OH(g) +3O2(g) = 2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1
由盖斯定律可知,③-②×2+①×4得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=△H33-△H22-△H3=-(Q3-2Q2+4Q1)kJ·mol-1,1mol液态甲醇完全燃烧放出热量为 ![]() ×(Q3-2Q2+4Q1)kJ·mol-1=(0.5Q3-Q2+2Q1)kJ。
×(Q3-2Q2+4Q1)kJ·mol-1=(0.5Q3-Q2+2Q1)kJ。
所以答案是:B。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,m、n、p、q、s是由这些元素中的两种或三种元素组成的化合物,r是由元素C形成的单质,上述物质的转化关系如图所示。常温下0.01 mol·L-1s溶液的pH为12。下列说法正确的是
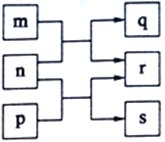
A. 原子半径的大小B<C<D
B. 化合物n与s中均既含有离子键,又含有共价键
C. 1L0.1mol·L-1的q溶液中阴离子总数等于0.1NA
D. 1mol n与足量的p完全反应可生成11.2L的r
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃、101 kPa下,0.5 mol辛烷C8H8燃烧生成二氧化碳和液态水时放出2 759 kJ热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
O2(g)=8CO2(g)+9H2O(g) ΔH=-48.40 kJ·mol-1
B.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C.C8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=+5 518 kJ·mol-1
D.2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) ΔH=+11 036 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1.43 g Na2CO3·xH2O 溶于水配成10 mL 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0 mL,并收集到112 mL CO2(标准状况)。
(1)Na2CO3·xH2O的摩尔质量为。
(2)稀盐酸物质的量浓度为。
(3)x值为 , 碳酸钠溶液的物质的量浓度为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1 L 0.5 mol/L Na2CO3溶液中含有的CO32-数目为0.5NA
B. 物质的量浓度为0.5mol/LAlCl3溶液中,含有Cl-个数为1.5NA
C. 6g乙烷中含有的共价键的数目为1.4NA
D. l mol甲基(- CH3)所含电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)CO(g)+H2(g)在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持容器体积不变,充入N2
D.保持容器体积不变,充入H2O(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A.加入少量W,逆反应速度增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的△H增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com