
| m |
| M |
| m |
| M |
| m |
| M |
| n |
| V |
| 17g |
| 34g/mol |
| m |
| M |
| 71g |
| 71g/mol |
| 2mol |
| 1L |
| 20mL×2mol/L |
| 200mL |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
7 3 |
23 11 |
24 12 |
14 6 |
14 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
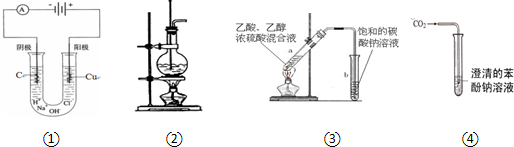
| A、装置①可用于实验室制取少量氯气 |
| B、装置②可用于实验室制取少量乙烯 |
| C、装置③可用于制备少量的乙酸乙酯 |
| D、装置④可用于比较碳酸与苯酚的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能使红色石蕊试纸显蓝色的溶液:K+、Na+、SO42-、C2O42- |
| B、能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br- |
| C、水电离出的c(H+)=10-12 mol/L的溶液:Ba2+、Na+、SO3-、S2- |
| D、加入铝条有氢气放出的溶液:Na+、NH4+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com