
| t/s | 0 | 5 | 15 | 25 | 35 |
| N(M)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 35s时,N的浓度为0.80mol•L-1 | |
| B. | 达到平衡时,M的转化率为80% | |
| C. | 相同温度下若起始时向容器中充入1.0molP,则达到平衡时P的浓度为0.1mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20molM、0.20molN和1.0molP,反应达到平衡前v(逆)<v(正) |
分析 M的物质的量达到0.80mol反应达到平衡状态,则
M(g)+N(g)?P(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20
K=$\frac{\frac{0.20}{2}}{\frac{0.80}{2}×\frac{0.80}{2}}$=0.625,
A.35s时N的物质的量为0.8mol,根据c=$\frac{n}{V}$计算其浓度;
B.达到平衡时M的物质的量为0.80mol,反应转化了0.20mol,据此计算出其转化率;
C.相同温度下若起始时向容器中充入1.0molP,与原平衡互为等效平衡,平衡时P的物质的量为0.20mol,根据c=$\frac{n}{V}$计算P的浓度;
D.计算平衡常数,结合起始量计算浓度商计算与平衡常数对比判断反应进行的方向.
解答 解:M的物质的量达到0.80mol反应达到平衡状态,则
M(g)+N(g)?P(g)
起始量(mol) 1.0 1.0 0
变化量(mol) 0.20 0.20 0.20
平衡量(mol) 0.80 0.80 0.20
K=$\frac{\frac{0.20}{2}}{\frac{0.80}{2}×\frac{0.80}{2}}$=0.625,
A.35s时N的物质的量为0.80mol,则N的浓度为:$\frac{0.8mol}{2L}$=0.40mol•L-1,故A错误;
B.平衡时M的物质的量为0.80mol,则反应消耗M的物质的量为:1mol-0.80mol=0.20mol,M的转化率为:$\frac{0.20mol}{1.0mol}$×100%=20%,故B错误;
C.相同温度下若起始时向容器中充入1.0molP,与1molM、1molN等效,则平衡时P的物质的量仍然为0.20mol,P的浓度为:$\frac{0.20mol}{2L}$0.1mol/L,故C正确;
D.相同温度下,起始时向容器中充入0.20molM、0.20molN和1.0molP,Qc=$\frac{\frac{1.0}{2}}{\frac{0.20}{2}×\frac{0.20}{2}}$=50>K=0.625,说明反应向着逆向进行,反应达到平衡前v(逆)>v(正),故D错误;
故选C.
点评 本题考查化学平衡有关计算,为高频考点,题目难度中等,涉及等效平衡、化学平衡常数与浓度商之间关系等知识点,侧重考查学生分析能力及计算能力,难点是C选项,注意利用平衡常数进行判断.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题

| A. | 3种单体通过缩聚反应聚合 | B. | 形成该化合物的单体只有2种 | ||
| C. | 其中一种单体为 | D. | 其中一种单体为1,5-二甲基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质熔点:Z>W | B. | 离子半径:X<Y | ||
| C. | 氧化物对应水化物的酸性:X>Z | D. | X和Z可存在于同一离子化合物中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
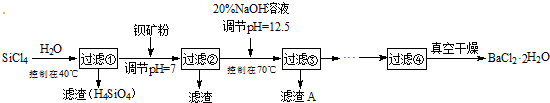
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
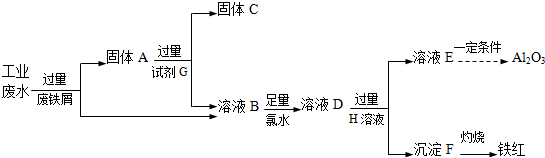
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液和稀盐酸,生成白色沉淀,可确定有Cl-存在 | |
| B. | 用洁净铂丝蘸取该溶液在火焰上灼烧,产生黄色火焰,则原溶液中一定含有钠盐 | |
| C. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32- | |
| D. | 加入KSCN溶液,溶液不变红,再加氯水后溶液显红色,则原溶液一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定中涉及的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | KMnO4标准溶液常用硫酸酸化,若用HNO3酸化,会使测定结果偏低 | |
| C. | KMnO4标准溶液盛放在酸式滴定管中 | |
| D. | 该实验选择酚酞做指示剂,当待测液颜色由无色变为浅红色时即达到滴定终点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 53g碳酸钠中含NA个CO32- | |
| B. | 0.1molOH-含NA电子 | |
| C. | 22.4LHCl溶于水,溶液中H+数为NA | |
| D. | 标准状况下11.2L臭氧(O3)中含NA个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com