
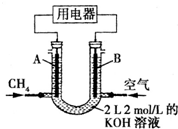
 将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.
将CH4设计成燃料电池,其利用率更高,装置如右图所示(A、B为多孔碳棒).持续通入甲烷,在标准状况下,消耗甲烷的体积为V L.分析 (1)负极发生氧化反应,负极反应为:CH4-8e-+10OH-=CO32-+7H2O;
(2)当消耗甲烷的体积为22.4L(标况下)时,甲烷的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,而总的电极反应式为:CH4+2O2+2KOH=K2CO3+3H2O,消耗氢氧化钾为2mol,根据c=$\frac{n}{V}$进行计算求解.
解答 解:(1)负极发生氧化反应,负极反应为:CH4-8e-+10OH-=CO32-+7H2O;故答案为:CH4-8e-+10OH-=CO32-+7H2O;
(2)当消耗甲烷的体积为22.4L(标况下)时,甲烷的物质的量为:$\frac{22.4L}{22.4L/mol}$=1mol,而总的电极反应式为:CH4+2O2+2KOH=K2CO3+3H2O,消耗氢氧化钾为2mol,则此时溶液中KOH的物质的量浓度为$\frac{4-2}{2}$=1mol/L,故答案为:1mol/L.
点评 本题考查了通过计算书写燃料电池的电极反应式等重要考点,涉及的知识点较多,综合性较强,难度较大.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应物总能量低于生成物总能量时,该反应一定不能发生 | |
| B. | 化学键的键能越大,物质的能量越高 | |
| C. | 一个反应的焓变因反应物的用量和反应条件的改变而发生改变 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入含HClO的溶液中生成H2SO4 HClO的酸性比H2SO4强 | |
| B. | 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔表面氧化铝熔点高于铝 | |
| C. | SiO2可以和碱溶液及酸溶液反应 SiO2属于两性氧化物 | |
| D. | 将SO2通入溴水中,溴水褪色 SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期的核电荷数和最高化合价之间的关系 | |
| B. | 烷烃中碳原子数(X)与氢原子数(Y)的关系 | |
| C. | 温度大于100℃时,CH4和C2H4的混合气体在氧气中充分燃烧,同温同压下燃烧前后参与反应的气体的体积之和(X)与生成物的气体体积之和(Y)的关系 | |
| D. | 燃烧一定质量C2H4与C3H6的混合气体,消耗O2的物质的量(Y)与C3H6的质量分数(X)的关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com