

 .
. ,反应类型:加聚反应.
,反应类型:加聚反应. 
分析 乙烯与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,B与D反应生成乙酸乙酯(CH3COOCH2CH3),则D为CH3COOH,乙烯发生加聚反应生成聚乙烯.
解答 解:乙烯与水发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,B与D反应生成乙酸乙酯(CH3COOCH2CH3),则D为CH3COOH,乙烯发生加聚反应生成聚乙烯.
(1)乙烯的结构式为: ,故答案为
,故答案为 ;
;
(2)D为CH3COOH,含有的官能团为羧基,故答案为:羧基;
(3)①乙烯与水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,
③是乙烯发生加聚反应生产聚乙烯,n CH2=CH2$\stackrel{一定条件}{→}$ ,
,
B→C是乙醇在Cu或Ag作催化剂条件下发生氧化反应CH3CHO,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,加成反应;
n CH2=CH2$\stackrel{一定条件}{→}$ ,加聚反应;
,加聚反应;
2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应;
(4)乙烯与空气平均相对分子质量接近,采取排水法收集,进气管要短,出水管长,
故选:③.
点评 本题考查有机物推断,涉及烯与醇、醛、羧酸之间的转化关系等,难度不大,注意基础知识的理解掌握.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
 碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响.
碳和氮是地球上含量丰富的两种元素,其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响. CO2(g)+NO(g)△H=a-bkJ/mol或△H=-(b-a)kJ/mol;
CO2(g)+NO(g)△H=a-bkJ/mol或△H=-(b-a)kJ/mol;| 温度/℃ | n (C)/mol | n(CO2)/mol |
| T1 | 0.3 | |
| T2 | 0.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3.H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①H2SO4溶液中HSO4- | ②NaHSO4溶液中HSO4- | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,G中的化学键有离子键、共价键,D跟G反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.
,G中的化学键有离子键、共价键,D跟G反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油是混合物,其分馏产品汽油为纯净物 | |
| B. |  的核磁共振氢谱中有4种峰 的核磁共振氢谱中有4种峰 | |
| C. | 苯甲酸的重结晶实验中,粗苯甲酸溶解后还要加点水的目的是减少过滤时苯甲酸的损失 | |
| D. | 苯中滴加浓溴水,充分震荡后溴水层褪色,是因为苯与溴水中的溴发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
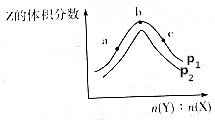 一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )
一定温度下,某密闭容器中存在反应:X(g)+2Y(g)?2Z(g),测得平衡体系中Z的体积分数与体系的压强(p)、投料比[b(Y):n(X)]关系如图所示,下列分析一定正确的是( )| A. | p2>p1 | B. | Y的转化率:a<c<b | ||
| C. | b点时n(Y):n(X)=2 | D. | 该反应是一个放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com