
(11分)
下图为实验室制取和收集纯净干燥的氯气,并进行氯气的性质实验的装置图:
(1)反应前,在装置A中 装浓盐酸(填写仪器名称)
装MnO2(填写仪器名称)
装置A中反应的化学方程式为 。
(2)装置B中的现象是
反应的化学方程式为 。
(3)装置D中所装试剂是 ,作用是 。
(4)装置F中发生反应的离子方程式为
(共11分)
(1)分液漏斗(1分) 圆底烧瓶(1分)
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(2)溶液变蓝(1分) Cl2 + 2KI =" 2KCl" + I2(2分)
(3)浓硫酸(1分) 吸收水分(干燥气体)(1分)
(4)Cl2 + 2OH- =Cl- +ClO- +H2O(2分)
解析试题分析:(1)反应前,在装置A中分液漏斗装浓盐酸;圆底烧瓶装MnO2 ;装置A中反应的化学方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)氯气会和装置B中的碘化钾反应会生成碘单质,所以现象是溶液变蓝;
反应的化学方程式为Cl2 + 2KI =" 2KCl" + I2。
(3)装置D中所装试剂是浓硫酸 ,作用是吸收水分(干燥气体)。
(4)装置F是尾气的处理装置,应盛放氢氧化钠,所以装置F中发生反应的离子方程式为Cl2 + 2OH- =Cl- +ClO- +H2O。
考点:实验室制取氯气 氯气的性质
点评:此题要求学生熟练掌握氯气的相关性质及实验室条件下制备方法。实验室制取氯气的方法和步骤如下:
(1)仪器设备:铁架台、酒精灯、石棉网、园底烧瓶、分液漏斗配双孔塞、导气管、集气瓶、小烧杯
(2)试剂:氢氧化钠溶液、浓盐酸、二氧化锰
(3)步骤:(A)把装置连接好,检查气密性
(B)在烧瓶中加入少量二氧化锰,从分液漏头里慢慢地注入密度为1。19的浓盐酸
(C)缓缓加热,使反应加快,有氮气均匀放出。
(D)用向上排空气法收集
(E)多余氮气用氢氧化钠吸收。


科目:高中化学 来源: 题型:
化学实验兴趣小组在实验室 进行氢气在氯气中的燃烧实验。
设计如下图所示装置I制备和收焦干燥纯净的氯气以备后续实验;

烧瓶中发生反应的离子方程式为 ;
请根据实验目的将装置I中虚线框内装置补充完整并在括号内注明所需试剂;
在右图所示装置Ⅱ中,在试管中先加入过量铁粉,再滴入少量CaSO4溶液,最后加入一定量稀盐酸,塞上胶塞,观察到有大量气泡产生。

①检查制取氢气装置气密性的操作方法是
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是
当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示); ;B组同学向集气瓶中注入适量水,用力振荡后,向中满入少量Na2SO3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:
①
②
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)化学实验兴趣小组在实验室 进行氢气在氯气中的燃烧实验。
(一)设计如下图所示装置I制备和收焦干燥纯净的氯气以备后续实验;
烧瓶中发生反应的离子方程式为 ;
请根据实验目的将装置I中虚线框内装置补充完整并在括号内注明所需试剂;
(二)在上图所示装置Ⅱ中,在试管中先加入过量铁粉,再滴入少量CaSO4溶液,最后加入一定量稀盐酸,塞上胶塞,观察到有大量气泡产生。
①检查制取氢气装置气密性的操作方法是
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是
(三)当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示); ;B组同学向集气瓶中注入适量水,用力振荡后,向中满入少量Na2SO3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:
①
查看答案和解析>>
科目:高中化学 来源:09~10学年浙江舟山七校高二下学期期末考试化学试题 题型:实验题
(12分)化学实验兴趣小组在实验室进行氢气在氯气中的燃烧实验。
(一)设计如下图所示装置I制备和收焦干燥纯净的氯气以备后续实验;
烧瓶中发生反应的离子方程式为 ;
请根据实验目的将装置I中虚线框内装置补充完整并在括号内注明所需试剂;
(二)在上图所示装置Ⅱ中,在试管中先加入过量铁粉,再滴入少量CaSO4溶液,最后加入一定量稀盐酸,塞上胶塞,观察到有大量气泡产生。
①检查制取氢气装置气密性的操作方法是
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是
(三)当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示); ;B组同学向集气瓶中注入适量水,用力振荡后,向中满入少量Na2SO3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:
①
查看答案和解析>>
科目:高中化学 来源:09-10学年浙江舟山七校高二下学期期末考试化学试题 题型:实验题
(12分)化学实验兴趣小组在实验室 进行氢气在氯气中的燃烧实验。
(一)设计如下图所示装置I制备和收焦干燥纯净的氯气以备后续实验;

烧瓶中发生反应的离子方程式为 ;
请根据实验目的将装置I中虚线框内装置补充完整并在括号内注明所需试剂;
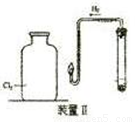
(二)在上图所示装置Ⅱ中,在试管中先加入过量铁粉,再滴入少量CaSO4溶液,最后加入一定量稀盐酸,塞上胶塞,观察到有大量气泡产生。
①检查制取氢气装置气密性的操作方法是
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是
(三)当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示); ;B组同学向集气瓶中注入适量水,用力振荡后,向中满入少量Na2SO3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:
①
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验兴趣小组在实验室 进行氢气在氯气中的燃烧实验。
(一)设计如下图所示装置I制备和收焦干燥纯净的氯气以备后续实验;

烧瓶中发生反应的离子方程式为 ;
请根据实验目的将装置I中虚线框内装置补充完整并在括号内注明所需试剂;

(二)在上图所示装置Ⅱ中,在试管中先加入过量铁粉,再滴入少量CaSO4溶液,最后加入一定量稀盐酸,塞上胶塞,观察到有大量气泡产生。
①检查制取氢气装置气密性的操作方法是
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是
(三)当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示); ;B组同学向集气瓶中注入适量水,用力振荡后,向中满入少量Na2SO3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:
①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com