
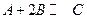 ·Ö±šŌŚČżÖÖ²»Ķ¬ŹµŃéĢõ¼žĻĀ½ųŠŠ£¬ĖüĆĒµÄĘšŹ¼ÅØ¶Č¾łĪŖ
·Ö±šŌŚČżÖÖ²»Ķ¬ŹµŃéĢõ¼žĻĀ½ųŠŠ£¬ĖüĆĒµÄĘšŹ¼ÅØ¶Č¾łĪŖ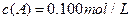 ”¢
”¢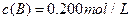 ¼°
¼°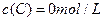 ”£·“Ó³ĪļAµÄÅضČĖꏱ¼äµÄ±ä»ÆČēĻĀĶ¼ĖłŹ¾”£
”£·“Ó³ĪļAµÄÅضČĖꏱ¼äµÄ±ä»ÆČēĻĀĶ¼ĖłŹ¾”£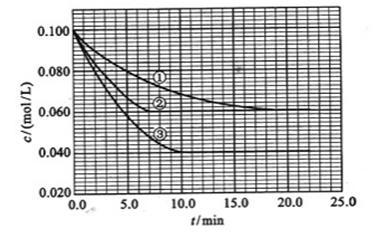

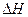 >0£¬ÅŠ¶ĻĘäĄķÓÉŹĒ________________£»
>0£¬ÅŠ¶ĻĘäĄķÓÉŹĒ________________£»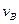 =___________£»
=___________£» =_______________”£
=_______________”£ Ķ¬²½Ń§µäŅ»æĪ¶ąĮ·ĻµĮŠ“š°ø
Ķ¬²½Ń§µäŅ»æĪ¶ąĮ·ĻµĮŠ“š°ø ¾µäĆܾķĻµĮŠ“š°ø
¾µäĆܾķĻµĮŠ“š°ø ½šÅĘæĪĢĆĮ·ĻµĮŠ“š°ø
½šÅĘæĪĢĆĮ·ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®»Æѧ·“Ó¦ĖŁĀŹĄķĀŪŹĒŃŠ¾æŌõŃłŌŚŅ»¶ØŹ±¼äÄŚæģ³ö²śĘ· |
| B£®»ÆŃ§Ę½ŗāĄķĀŪŹĒŃŠ¾æŌõŃłŹ¹ÓĆÓŠĻŽŌĮĻ¶ą³ö²śĘ· |
| C£®»Æѧ·“Ó¦ĖŁĀŹĄķĀŪŹĒŃŠ¾æŌõŃłĢįøßŌĮĻ×Ŗ»ÆĀŹ |
| D£®»ÆŃ§Ę½ŗāĄķĀŪŹĒŃŠ¾æŌõŃłŹ¹ŌĮĻ¾”æÉÄܶąµŲ×Ŗ»ÆĪŖ²śĘ· |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 cZ(g)+dW(g),5 minŗó“ļµ½Ę½ŗā£¬X¼õÉŁn mol”¤L-1£¬Y¼õÉŁ
cZ(g)+dW(g),5 minŗó“ļµ½Ę½ŗā£¬X¼õÉŁn mol”¤L-1£¬Y¼õÉŁ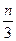 mol”¤L-1,ZŌö¼Ó
mol”¤L-1,ZŌö¼Ó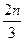 mol”¤L-1”£ŌŚĘäĖūĢõ¼ž²»±äŹ±£¬½«ČŻĘ÷Ģå»żŌö“ó£¬WµÄ°Ł·Öŗ¬Įæ²»·¢Éś±ä»Æ”£Ōņ»Æѧ·½³ĢŹ½ÖŠø÷ĪļÖŹµÄ»Æѧ¼ĘĮæŹżÖ®±Ča”Ćb”Ćc”ĆdÓ¦ĪŖ£Ø £©
mol”¤L-1”£ŌŚĘäĖūĢõ¼ž²»±äŹ±£¬½«ČŻĘ÷Ģå»żŌö“ó£¬WµÄ°Ł·Öŗ¬Įæ²»·¢Éś±ä»Æ”£Ōņ»Æѧ·½³ĢŹ½ÖŠø÷ĪļÖŹµÄ»Æѧ¼ĘĮæŹżÖ®±Ča”Ćb”Ćc”ĆdÓ¦ĪŖ£Ø £©| A£®1”Ć3”Ć1”Ć2 | B£®3”Ć1”Ć2”Ć2 | C£®3”Ć1”Ć2”Ć1 | D£®1”Ć3”Ć2”Ć2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®0.6 mol | B£®1.8 mol | C£®1.2 mol | D£®1.5 mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2C(Ęų)ŌŚ×ī³õ0.2sÄŚ£¬ĻūŗÄAµÄĘ½¾łĖŁĀŹĪŖ0.06mol”¤(L”¤S)-1£®ŌņŌŚ0.2sŹ±£¬ÕęæÕĻäÖŠCµÄĪļÖŹµÄĮæŹĒ£Ø £©
2C(Ęų)ŌŚ×ī³õ0.2sÄŚ£¬ĻūŗÄAµÄĘ½¾łĖŁĀŹĪŖ0.06mol”¤(L”¤S)-1£®ŌņŌŚ0.2sŹ±£¬ÕęæÕĻäÖŠCµÄĪļÖŹµÄĮæŹĒ£Ø £©| A£®0.12mol | B£®0.08mol | C£®0.04mol | D£®0.8mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
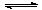 2NH3µÄ·“Ó¦£¬ĻĀĮŠŃ”ĻīÖŠÄÜĖµĆ÷·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ
2NH3µÄ·“Ó¦£¬ĻĀĮŠŃ”ĻīÖŠÄÜĖµĆ÷·“Ó¦ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ| A£®c(N2)”Ćc(H2)”Ćc(NH3)£½1”Ć3”Ć2 |
| B£®2v(H2)£½3v(NH3) |
| C£®µ„Ī»Ź±¼äÄŚ1øöN”ŌN¼ü¶ĻĮѵÄĶ¬Ź±£¬ÓŠ6øöN£H¼ü¶ĻĮŃ |
| D£®µ„Ī»Ź±¼äĻūŗÄ0.1molN2µÄĶ¬Ź±£¬Éś³É0.2molNH3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2C(g)£¬2 sŹ±²āµĆCµÄÅضČĪŖ0.6mol”¤L£1”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
2C(g)£¬2 sŹ±²āµĆCµÄÅضČĪŖ0.6mol”¤L£1”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ| A£®ÓĆĪļÖŹA±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.3mol/(L”¤s) |
| B£®ÓĆĪļÖŹB±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.6mol/(L”¤s)£» |
| C£®2 sŹ±ĪļÖŹAµÄ×Ŗ»ÆĀŹĪŖ70% |
| D£®2 sŹ±ĪļÖŹBµÄÅضČĪŖ0.7mol”¤L£1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā


 £¬
£¬ £¬ŌŚÄ³ĪĀ¶ČŹ±
£¬ŌŚÄ³ĪĀ¶ČŹ± µÄÅضČĖꏱ¼ä±ä»ÆµÄĒśĻߣŗ
µÄÅضČĖꏱ¼ä±ä»ÆµÄĒśĻߣŗ ĻĀĮŠÓŠ¹ŲøĆ·“Ó¦µÄĆčŹöÕżČ·µÄŹĒ
ĻĀĮŠÓŠ¹ŲøĆ·“Ó¦µÄĆčŹöÕżČ·µÄŹĒA£®µŚ6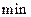 ŗ󣬷“Ó¦¾ĶÖÕÖ¹ĮĖ ŗ󣬷“Ó¦¾ĶÖÕÖ¹ĮĖ |
B£® µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ85% µÄĘ½ŗā×Ŗ»ÆĀŹĪŖ85% |
C£®ČōÉżøßĪĀ¶Č£¬ µÄĘ½ŗā×Ŗ»ÆĀŹ½«“óÓŚ85% µÄĘ½ŗā×Ŗ»ÆĀŹ½«“óÓŚ85% |
| D£®Čō½µµĶĪĀ¶Č£¬vÕż> vÄę |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
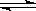 qZ(g) ”÷H£¾0£¬m + n£¾q£¬ŌŚĢå»żŅ»¶ØµÄĆܱÕČŻĘ÷ÖŠ“ļµ½Ę½ŗā£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ( )
qZ(g) ”÷H£¾0£¬m + n£¾q£¬ŌŚĢå»żŅ»¶ØµÄĆܱÕČŻĘ÷ÖŠ“ļµ½Ę½ŗā£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ( )| A£®·“Ó¦ĖŁĀŹ¦ŌÕż(X) =(n/m)¦ŌÄę(Y) | B£®¼ÓČėX£¬·“Ó¦µÄ”÷HŌö“ó |
| C£®Ōö¼ÓYµÄĪļÖŹµÄĮ棬XµÄ×Ŗ»ÆĀŹŌö“ó | D£®½µµĶĪĀ¶Č£¬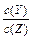 µÄÖµ±äŠ” µÄÖµ±äŠ” |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com