
铬是由法国化学家沃克兰于1798年在巴黎发现的。目前铬被广泛应用于冶金、化工、铸铁、耐火及高精端科技等领域。
(1)铬元素基态原子的电子排布式为____________,其核外未成对电子数为__________。
(2)金属铬的第二电离能(ICr)和锰的第二电离能(IMn)分别为1590.6kJ·mol-1、1509.0 kJ·mol-1,ICr>IMn的原因是__________。
(3)雷氏盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2].H2O是一种易溶于水和乙醇的暗红色固体。
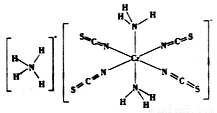
①雷氏盐中铬元素的化合价为_______,NH3与铬离子形成的化学键为__________。
②NCS-的立体构型是________,其中碳原子的杂化轨道类型为_______。SO2、CO2、BaCl2、SCl2四种分子中,与NCS-互为等电子体的是_____________。
③乙醇的沸点比溴乙烷高,其原因是__________。
(4)硒化铬的晶胞结构如图所示,晶胞参数为anm和bnm,则硒化铬的密度为____________g·cm-3(列出表达式即可)。

科目:高中化学 来源:2017届吉林省长白山市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
有机物C4H8Cl2的结构中只含有一个甲基的同分异构体有几种(不考虑立体结构)
A. 8 B. 7 C. 4 D. 3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:选择题
关于合金性质的说法中,错误的是( )
A. 合金的硬度一般比其各成分金属的硬度高
B. 合金的熔点一般比其各成分金属的熔点低
C. 合金的物理性质一般与其各成分金属的的物理性质不同
D. 合金的化学性质一般与其各成分金属的的化学性质不同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列关于氢键的说法正确的是
A. 冰、水和水蒸气中都存在氢键
B. 氢键是一种化学键
C. HF的沸点比HCl的沸点高,是由于HF分子之间存在氢键
D. NH3的稳定性很强,是因为其分子间能形成氢键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A. 由H原子形成1 mol H—H键要吸收能量
B. 所有燃烧的反应都是放热反应
C. 铝条与盐酸的反应是吸热反应
D. 凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
科目:高中化学 来源:2017届山东省菏泽市高三一模理综化学试卷(解析版) 题型:选择题
以铬酸钾(K2CrO4)为原料用电化学法制备K2Cr2O7的装置如图,下列说法正确的是
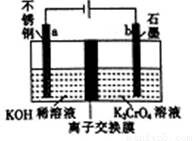
A. a极的电极反应为:2H2O+2e-=2OH-+H2↑
B. 电解过程中氢氧化钾溶液的浓度保持不变
C. b极上CrO42-发生氧化反应生成Cr2O72-
D. 电解过程中H+从右侧通过离子交换膜迁移到左侧
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第五次模拟考试理综化学试卷(解析版) 题型:简答题
硒(Se),是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1) Se原子的核外电子排布式为____________。
(2) 比较As的第一电离能比Se______(填“大”或“小”)。
(3) SeO42-中Se-O的键角比SeO3的键角____(填“大”或“小”)原因是______________
(4) H2SeO4比H2SeO3水溶液的酸性___________。
(5) 硒单质是红色或灰色粉末,带灰色金属光泽的准金属,灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。
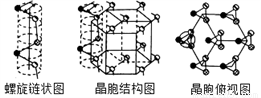
螺旋链中Se原子的杂化方式为__________。己知正六棱柱的边长为acm,高为b cm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的Se原子个数为_________,该晶体的密度为___________g/cm3 (用含NA、a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省抚顺市高三3月模拟考试理科综合化学试卷(解析版) 题型:选择题
以下有机物同分异构体数目判断中不正确的是
A. 立方烷( )的六氨基(-NH2)取代物有3种。
)的六氨基(-NH2)取代物有3种。
B. C3H7ClO(有羟基)的同分异构体数目有5种
C. 甲苯与氢气充分加成后的—溴代物有4种。
D. 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省大庆市高三第二次教学质量检测(二模)理科综合化学试卷(解析版) 题型:实验题
1.
硫代硫酸钠是一种重要的化工产品,某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,受热、遇酸均反应,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]实验装置如图所示(省略夹持装置):
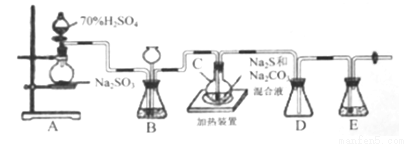
烧瓶C中发生反应如下:
Na2CO3(aq)+SO2(g)=Na2SO3(aq)+CO2(g)
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)
S(s)+Na2SO3(aq)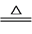 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
(1)检查装置气密性。仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若__________,则整个装置气密性良好:装置E的作用是__________。
(2)按图示加入试剂。向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再加热C,A中反应的化学方程式是______;为提高产品纯度,应使C中Na2CO3和Na2S恰好完全反应,则C烧瓶中Na2CO3和Na2S物质的量之比为_______ 。
(3)装置B的另一作用是观察SO2的生成速率,其中的液体最好选择_____。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中要控制SO2生成速率,使SO2缓慢进入C中可采取的措施有_______;为了保证硫代硫酸钾的产量,该实验一般控制在碱性环境下进行。否则产品发黄,原因是______。
(4)等Na2S和Na2CO3完全消耗后,结束反应。趁热过滤C中混合物,将滤液水浴加热浓缩、_____,经过滤、洗涤、干燥,得到产品。
Ⅲ.[探究与反思]
为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_____(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择),若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com