
以下物质;① 甲烷;② 苯;③ 聚乙烯;④ 聚乙炔;⑤ 2-丁炔;⑥ 环己烷;⑦ 邻二甲苯;⑧ 苯乙烯。既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
A.③④⑤⑧ B.④⑤⑦⑧ C.④⑤⑧ D.③④⑤⑦⑧
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
标准状况下,某同学向100 mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
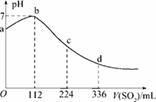 A.ab段反应是:SO2+2H2S===3S↓+2H2O
A.ab段反应是:SO2+2H2S===3S↓+2H2O
B.亚硫酸是比氢硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05 mol/L
D.b点对应的溶液导电性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
苹果酸的结构简式为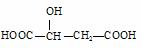 ,下列说法正确的是( )
,下列说法正确的是( )
A.HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
B.1mol苹果酸可与3mol NaOH发生中和反应
C.1mol苹果酸与足量金属Na反应生成生成1mol H2
D.苹果酸在一定条件下能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A.若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C.反应①②转移的电子数相同
D.反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2A2(g)+B2(g) 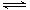 2C
2C 3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为________。
A2的转化率为________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系
之间满足何种关系
(4)能说明该反应已经达到平衡状态的是 。
a.v(C3)=2 v (B2); b.容器内压强保持不变 
 c.2v逆(A2)=v正(B2) d.容器内的密度保持不变
c.2v逆(A2)=v正(B2) d.容器内的密度保持不变
(5)改变某一条件,得到如图的变化规律 (图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d. b点A2和B2的物质的量之比为2:1
(6)若将上述容器改为恒压容器(反应前体积相同),起 始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 (填“>”、“<”或“=”)。
始时加入2 molA2和l molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4 (填“>”、“<”或“=”)。
(7)下列措施可以同时提高反应速率和B2的转化率是(填选项序号) 。
a.选择适当的催化剂 b .增大压强 c.及时分离生成的C3 d.升高温度
.增大压强 c.及时分离生成的C3 d.升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
在11Na、12Mg、13Al、14Si、15P、16S、17Cl、18Ar八种元素中,能
用表示核外电 子排布的常见阳离子共有
A.1种 B.2种 C.3种 D.4种

查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量Fe、FeO、Fe2O3的混合物中,加入50mL 1mol/L硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A.11.2g B.5.6g C.2.8g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲、乙两个相同的恒容密闭容器,体积均为0.25 L,在相同温度下均发生可逆反应:X2(g)+3Y2(g)2XY3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
| 容器编号 | 起始时各物质的物质的量/mol | 平衡时体系 能量的变化 | ||
| X2 |
| XY3 | ||
| 甲 | 1 | 3 | 0 | 放出热量:23.15 kJ |
| 乙 | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.若容器甲体积为0.5 L,则平衡时放出的热量小于23.15 kJ
B.容器乙中达平衡时放出的热量Q=23.15 kJ
C.容器甲、乙中反应的平衡常数相等
D.平衡时,两个容器中XY3的体积分数均为1/7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com