
| A. | 用丁达尔效应鉴别氢氧化铁胶体和稀豆浆 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| C. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| D. | 用加热方法可以除去MgCl2中的NH4HCO3 |
分析 A.氢氧化铁胶体和稀豆浆均为胶体;
B.溶液、胶体均可透过滤纸;
C.BaSO4、BaCO3均溶于水;
D.NH4HCO3加热分解生成氨气、水、二氧化碳,而氯化镁不分解.
解答 解:A.氢氧化铁胶体和稀豆浆均为胶体,则丁达尔效应不能鉴别,故A错误;
B.溶液、胶体均可透过滤纸,不能利用过滤法分离,故B错误;
C.BaSO4、BaCO3均溶于水,则溶解、过滤不能分离,故C错误;
D.NH4HCO3加热分解生成氨气、水、二氧化碳,而氯化镁不分解,则加热法可分离,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 溴化碘与Br2、I2具有相似的化学性质 | |
| B. | 在许多反应中,IBr是一种强氧化剂 | |
| C. | 在溴化碘与水反应中,IBr既是氧化剂,又是还原剂 | |
| D. | 溴化碘与氢氧化钠溶液反应时可生成两种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
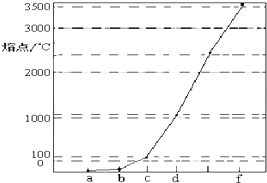
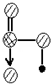 请简要说明该物质易溶于水的原因
请简要说明该物质易溶于水的原因查看答案和解析>>
科目:高中化学 来源: 题型:解答题
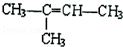 的名称是2-甲基-2-丁烯
的名称是2-甲基-2-丁烯 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲~庚元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚元素在周期表中的相对位置如图,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差27 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 丁的最高价氧化物可用于制造光导纤维 | |
| D. | 常温下,甲和乙的单质均能与水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+)=10-12 mol•L-1的溶液中:Na+、Cl-、HCO3-、SO42- | |
| B. | pH=12的澄清的溶液中:K+、Na+、MnO4-、SO42- | |
| C. | 甲基橙呈红色的溶液中:NH4+、Ba2+、AlO2-、Cl- | |
| D. | 加入少量铝粉后能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L的CO气体与l mol N2所含的电子数为14 NA | |
| B. | 物质的量浓度为0.5 mol/L Mg Cl2溶液,含有Cl-数为NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2 NA | |
| D. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移电子数为4 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com