
下列物质中,既能因化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是:( )
①SO2 ②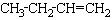 ③C6H6 ④C6H5-CH2CH3
③C6H6 ④C6H5-CH2CH3
| A.①②③④ | B.③④ | C.①② | D.①②④ |
科目:高中化学 来源:新人教版2012届高三上学期单元测试(6)化学试题 人教版 题型:022
现正开始使用一种安全气袋以防止汽车撞车时在驾驶室的人因向前冲撞发生意外.这种气袋内装有一种能在高温下分解出气体的混合物.例如有一种配方为:
61%-68% NaN3(叠氮化钠)、0%-5% NaNO3、0%-5%陶土、23%-28% Fe2O3粉、1%-2% SiO2粉、2%-6%石墨纤维.这些粉末经加压成型后,装在一个大袋子里,袋子放在驾驶室座位前.撞车时,约在10毫秒(10-3秒)内引发下列反应:2NaN3=2Na+3N2(365℃分解)反应在约30毫秒内完成,袋内充满N2气而胀大,阻止人体前冲.在以后的100~200毫秒内气体“消失”,所以不致使人反弹,同时袋内的钠变成氧化钠.
(1)你认为完成上述引发分解、生成气体的“消失”、钠变成氧化钠过程各需上述配方里哪些物质和起什么作用________.
(2)若气袋内放300 g NaN3,在充满氮气时,袋内气体体积为(1大气压,300 K)________L.若袋内气体压力达到4大气压(此时为350 K),则袋内气体体积为________L.
(3)配方中Fe2O3的量是如何控制的________.
(4)叠氮离子中有三个氮原子连成直线,N-N键等长(116 pm).写出其电子式________.
(5)怎样做到既使混合物在30毫秒内迅速分解,但又不燃烧、爆炸________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)现正开始使用一种安全气袋以防止汽车撞车时在驾驶室的人因向前冲撞发生意外。这种气袋内装有一种能在高温下分解出气体的混合物。例如有一种配方为:
61%—68%NaN3(叠氮化钠)、0%—5%NaNO3、0%—5%陶土、23%—28%Fe2O3粉、1%—2%SiO2粉、2%—6%石墨纤维。这些粉末经加压成型后,装在一个大袋子里,袋子放在驾驶室座位前。撞车时,约在10毫秒(10-3秒)内引发下列反应: 2NaN3=2Na+3N2(365℃分解)反应在约30毫秒内完成,袋内充满N2气而胀大,阻止人体前冲。在以后的100~200毫秒内气体“消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
(1)你认为完成上述引发分解、生成气体的“消失”、钠变成氧化钠过程各需上述配方里哪些物质和起什么作用 。
(2)若气袋内放300g NaN3,在充满氮气时,袋内气体体积为(1大气压,300K) L 。若袋内气体压力达到4大气压(此时为350K),则袋内气体体积为 L。
(3)配方中Fe2O3的量是如何控制的 。
(4)叠氮离子中有三个氮原子连成直线,N—N键等长(116pm)。写出其电子式 。
(5)怎样做到既使混合物在30毫秒内迅速分解,但又不燃烧、爆炸 。
查看答案和解析>>
科目:高中化学 来源:2012届高三上学期单元测试(6)化学试卷(新人教版) 题型:填空题
(10分)现正开始使用一种安全气袋以防止汽车撞车时在驾驶室的人因向前冲撞发生意外。这种气袋内装有一种能在高温下分解出气体的混合物。例如有一种配方为:
61%—68%NaN3(叠氮化钠)、0%—5%NaNO3、0%—5%陶土、23%—28%Fe2O3粉、1%—2%SiO2粉、2%—6%石墨纤维。这些粉末经加压成型后,装在一个大袋子里,袋子放在驾驶室座位前。撞车时,约在10毫秒(10-3秒)内引发下列反应: 2NaN3=2Na+3N2(365℃分解)反应在约30毫秒内完成,袋内充满N2气而胀大,阻止人体前冲。在以后的100~200毫秒内气体“ 消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
(1)你认为完成上述引发分解、生成气体的“消失”、钠变成氧化钠过程各需上述配方 里哪些物质和起什么作用 。
里哪些物质和起什么作用 。
(2)若气袋内放300g NaN3,在充满氮气时,袋内气体体积为(1大气压,300K) L 。若袋内气体压力达到4大气压(此时为350K),则袋内气体体积为 L。
(3)配方中Fe2O3的量是如何控制的 。
(4)叠氮离子中有三个氮原子连成直线,N—N键等长(116pm)。写出其电子式 。
(5)怎样做到既使混合物在30毫秒内迅速分解,但又不燃烧、爆炸 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年高三上学期单元测试(6)化学试卷(新人教版) 题型:综合题
(10分)现正开始使用一种安全气袋以防止汽车撞车时在驾驶室的人因向前冲撞发生意外。这种气袋内装有一种能在高温下分解出气体的混合物。例如有一种配方为:
61%—68%NaN3(叠氮化钠)、0%—5%NaNO3、0%—5%陶土、23%—28%Fe2O3粉、1%—2%SiO2粉、2%—6%石墨纤维。这些粉末经加压成型后,装在一个大袋子里,袋子放在驾驶室座位前。撞车时,约在10毫秒(10-3秒)内引发下列反应: 2NaN3=2Na+3N2(365℃分解)反应在约30毫秒内完成,袋内充满N2气而胀大,阻止人体前冲。在以后的100~200毫秒内气体“消失”,所以不致使人反弹,同时袋内的钠变成氧化钠。
(1)你认为完成上述引发分解、生成气体的“消失”、钠变成氧化钠过程各需上述配方里哪些物质和起什么作用 。
(2)若气袋内放300g NaN3,在充满氮气时,袋内气体体积为(1大气压,300K) L 。若袋内气体压力达到4大气压(此时为350K),则袋内气体体积为 L。
(3)配方中Fe2O3的量是如何控制的 。
(4)叠氮离子中有三个氮原子连成直线,N—N键等长(116pm)。写出其电子式 。
(5)怎样做到既使混合物在30毫秒内迅速分解,但又不燃烧、爆炸 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com