

 .
.分析 实验室制备溴苯是用苯和液溴在铁粉作催化剂的条件下发生取代反应生成溴苯和溴化氢,根据装置图可知,生成溴苯的同进还有溴化氢生成另外还有少部分溴挥发,所以在D装置中石蕊会变红,E中的硝酸银会产生溴化银沉淀,尾气用氢氧化钠溶液吸收,关闭C打开F时,由于溴化氢极易溶于水,广口瓶中的水会倒吸入三颈烧瓶,
(1)根据溴苯的性质可知,溴苯是一种密度比水大的无色液体,在实验中因为溶解了不量的溴而显褐色,在三口烧瓶中铁与溴生成溴化铁,苯与溴在溴化铁作催化剂的条件下了生取代反应生成溴苯和溴化氢;
(2)反应产生的溴化氢气体遇到石蕊溶液,能石蕊溶液变红色,溴化氢气体通入硝酸银溶液,能产生浅黄色沉淀;
(3)氢氧化钠溶液能吸收溴化氢,倒置的漏斗能防止发生倒吸;
(4)溴化氢极易溶于水,容易发生倒吸,溴苯不溶于水;
(5)三口烧瓶中的溴苯含有少量的溴和溴化氢,可以用NaOH溶液除去,溴苯不溶于水且密度比水大,据此答题.
解答 解:实验室制备溴苯是用苯和液溴在铁粉作催化剂的条件下发生取代反应生成溴苯和溴化氢,根据装置图可知,生成溴苯的同进还有溴化氢生成另外还有少部分溴挥发,所以在D装置中石蕊会变红,E中的硝酸银会产生溴化银沉淀,尾气用氢氧化钠溶液吸收,关闭C打开F时,由于溴化氢极易溶于水,广口瓶中的水会倒吸入三颈烧瓶,
(1)在三口烧瓶中铁与溴生成溴化铁,苯与溴在溴化铁作催化剂的条件下了生取代反应生成溴苯和溴化氢,所以有关反应的化学方程式分别是2Fe+3Br2=2FeBr3、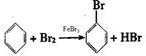 ,
,
故答案为:2Fe+3Br2=2FeBr3、 ;
;
(2)由于生成的溴化氢极易挥发,溶于水显酸性,则紫色石蕊试液变红,溴化氢溶于水和硝酸银反应生成溴化银淡黄色长的,即实验现象是溶液中有淡黄色沉淀生成,所以D管石蕊试液变红,E管出现浅黄色沉淀,
故答案为:管石蕊试液变红,管出现浅黄色沉淀;
(3)氢氧化钠溶液能吸收溴化氢,倒置的漏斗能防止发生倒吸,所以F的作用是吸收排出的溴化氢气体,防止污染空气,同时能防止倒吸,
故答案为:吸收排出的溴化氢气体,防止污染空气,同时能防止倒吸;
(4)由于溴化氢极易溶于水,所以待三颈烧瓶中的反应进行到仍有气泡冒出时松开G夹,关闭C夹,可以看到的现象是与B相连的广口瓶中水流入三颈烧瓶,溴苯不溶于水,所以A中会出现分层,
故答案为:水倒流进三口烧瓶,A中液体出现分层;
(5)三口烧瓶中的溴苯含有少量的溴和溴化氢,可以用NaOH溶液除去,溴苯不溶于水且密度比水大,所以将加过氢氧化钠溶液的混合溶液倒入分液漏斗中,振荡静置,后溴苯从分液漏斗的下口放出,
故答案为:除去多余的溴和溴化氢;分液漏斗;下.
点评 该题是高考中的常见题型,属于中等难度的试题,试题综合性强,难易适中.在注重对学生基础性知识考查和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的严谨规范的实验设计能力,也有利于提高学生的学科素养.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
 为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是( )
为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是( )| A. | 负极反应式:Ag+Cl-e-=AgCl | |
| B. | 每生成1 mol Na2Mn5O10转移2 mol电子 | |
| C. | Na2Mn5O10是还原产物 | |
| D. | Cl-不断向电池的正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”.特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 据题意分析可知该隔膜只允许Li+通过,放电时 Li+从左边流向右边 | |
| B. | 充电时,A为阴极,发生还原反应 | |
| C. | 放电时,B为正极,电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.| A. | 反应开始时,B容器中化学反应速率比A容器中快 | |
| B. | A容器中X的转化率为20%,且比B容器中X的转化率小 | |
| C. | 打开K一段时间,达新平衡时,A的体积为2.3a L(连通管中气体体积不计) | |
| D. | 打开K达新平衡时,升高B容器的温度,A容器的体积会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、MnO${\;}_{4}^{-}$、Cl- | B. | K+、Ag+、NO${\;}_{3}^{-}$、Cl- | ||
| C. | Ba2+、Na+、Cl-、SO${\;}_{4}^{2-}$ | D. | Na+、Cu2+、NO${\;}_{3}^{-}$、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com