
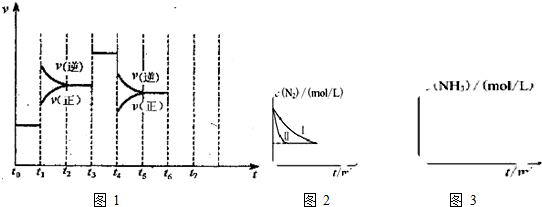
分析 (1)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率;t3正逆反应速率同等程度的增大;t4时正逆反应速率均减小,且逆反应速率大于正反应速率;
(2)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,根据移动结果分析;
(3)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线;
(4)合成氨反应为放热反应,升高温度平衡逆向移动,平衡时氨气浓度减小,但反应速率变快,所以达到平衡的时间变短,据此可画出图象.
解答 解:(1)由N2(g)+3H2(g)?2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;
t3正逆反应速率同等程度的增大,改变条件应为使用催化剂;
t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,
故答案为:升高温度;加入催化剂;减小压强(或增大容器体积);
(2)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,
故答案为:t0~t1;
(3)t6时刻分离出部分NH3,v逆立刻减小,而v正逐渐减小,在t7时刻二者相等,反应重新达平衡,据此可画出反应速率的变化曲线为: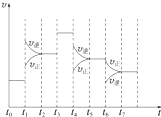 ,故答案为:
,故答案为: ;
;
(4)在实验Ⅲ中改变条件为采用比实验Ⅰ更高的温度,由于升高温度化学反应速率加快,达到平衡所需要的时间缩短,但是由于该反应是放热反应,升高温度,平衡向吸热的逆反应方向移动,因此达到平衡时NH3的含量降低,用图象表示实验I和实验Ⅲ中NH3浓度随时间变化的示意图是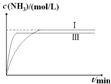 ,
,
故答案为: .
.
点评 本题考查影响化学反应速率的因素,注意把握反应的特点及图象分析是解答的关键,明确温度、压强、催化剂对反应速率的影响即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 臭氧空洞 | B. | 酸雨 | C. | 光化学烟雾 | D. | 温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
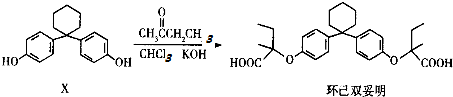
| A. | 有机物X的分子式为C18H22O2 | |
| B. | 有机物X与环己双妥明互为同系物 | |
| C. | 环己双妥明苯环上的一氯代物有4种 | |
| D. | 环己双妥明能与碳酸氢钠溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
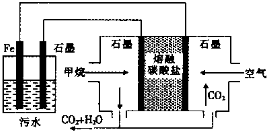
| A. | 左侧装置中的铁电极可换成石墨电极 | |
| B. | 通入甲烷的石墨电极的电极反应式为:CH4+4CO32--8e-═5CO2+2H2O | |
| C. | 通入空气的石墨电极做正极,发生氧化反应 | |
| D. | 若左侧装置中石墨电极产生标准状况下气体44.8L气体,则消耗2mol甲烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com