
�����ᵽ�������У����ε�ˮ���йص���(����)
��������FeCl3������ˮ��
��Ϊ����FeCl3��Һ��Ҫ����Һ�м���������
��ʵ��������AlCl3��Һʱ��Ӧ�Ȱ����ܽ��������У������ˮϡ��
��NH4Cl��ZnCl2��Һ���������еij����
��ʵ����ʢ��Na2CO3��Na2SiO3����Һ���Լ�ƿӦ����Ƥ�����������ò�����
����NaHCO3��Al2(SO4)3������Һ������ĭ����
����NH4Cl��AlCl3��Һ�м������þ����������
���ľ�����̬���ʲ��ܻ��ʩ��
��Ƚ�NH4Cl��Na2S����Һ������Ũ�ȵĴ�С��ijЩ����Һ�������
A���٢ܢ� B���ڢݢ� C���ۢޢ� D��ȫ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��CH4(g)+2O2(g)==CO2(g)+2H2O(1) ��H1 = �DQ1 KJ/mol
2H2(g)+O2(g)==2H2O(g) ��H2= �DQ2 KJ/mol
2H2(g)+O2(g)==2H2O(1) ��H3 = �DQ3KJ/mol
�����£�ȡ�����Ϊ4:1�ļ���������Ļ������11.2L�����ۺϳɱ�״����������ȫȼ�պ�ָ������£�������˵����ȷ���ǣ� ��
A���ų�������Ϊ��0.4Q1+0.1Q3��KJ
B���ų�������Ϊ��0.4Q1+0.05Q2��KJ
C�� �ų�������Ϊ��0.4Q1+0.05Q3��KJ
D����H2 <��H3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������������ijЩ���⣬�����漰����ѧ֪ʶ�����и���������ȷ����
A�����ӵ��Ρ������߸�ţ�̡���������Ӫ��Ʒ����ʳ��Ʒ�еĵ⡢�ơ�����ָ����
B��������Գ��⡱�����ȵĴ�����Һȥ���ۡ����Ƿ����˻�ѧ�仯
C��ҽ���Ͻ���θ����Ӱǰ�����߷��õġ����͡���BaCO3�Ȳ�����ˮ������
D�����Ͻ�Ĵ���ʹ�ù鹦���������ý�̿�Ȼ�ԭ�����������л�ȡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�л���A������ת����ϵ����A������ͼ���ʺɱ����ֵΪ88���������C��H��O����Ԫ�ص�������Ϊ6��1��4����A����ʹBr2��CCl4��Һ��ɫ��1mol B��Ӧ������2mol C��

��ش��������⣺
��1��C��E�ķ�Ӧ����Ϊ_______________________ ��
��2�����١��ڡ���������Ӧ�IJ��ʷֱ�Ϊ93.0%��81.0%��88.09%������A�ϳ�H���ܲ���Ϊ___________________ ��
��3��A�Ľṹ��ʽΪ__________________________ ��
��4��д��C��������Һ��Ӧ�����ӷ���ʽΪ________________________________ ��
��5��H����������̼ԭ�Ӿ���һ��ֱ���ϣ�Gת��ΪH�Ļ�ѧ����ʽΪ��
__________________________________________________________________ ��
��6��X��A��һ��ͬ���칹�壬����˴Ź���������3���壬�����֮��Ϊ1��1��2��1mol X����HIO4���ȵ������·�Ӧ������ֻ��1mol Y����X�Ľṹ��ʽΪ________________________________________________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʼ������þ���Բ�����������
A��HNO3 B��NaHCO3 C��NH4Cl D��CH3COONa
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£��� 0.1 000 mol��L-1NaOH��Һ�ζ� 20.00 mL 0.1000mol��L-1 CH3COOH��Һ�ζ���������ͼ��
000 mol��L-1NaOH��Һ�ζ� 20.00 mL 0.1000mol��L-1 CH3COOH��Һ�ζ���������ͼ��
����˵����ȷ����
A�������ʾ��Һ�У�c(CH3COO��)+ c(OH��)= c(CH3COOH) + c(H+)
+ c(H+)
B�������ʾ��Һ�У�c(Na+)= c(CH3COOH)+c(CH3COO��)
C�������ʾ��Һ�У�c(Na+)>c(OH��)>c(CH3COO��)>c(H+)
D���ζ������п��ܳ��֣�c(CH3COOH)>c(CH3COO��)>c(H+)>c(Na+)>c(OH��)
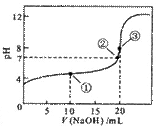
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1)��(Ce)�ǵؿ��к�����ߵ�ϡ��Ԫ�ء��ڼ���������CeCl3����ˮ�⣬��ˮCeCl3���ü���CeCl3��6H2O��NH4Cl��������ķ������Ʊ�������NH4Cl��������
(2)Na2S��Һ������Ũ���ɴ�С��˳��Ϊ____________________________________�������Һ�м�����������CuSO4����ҺpH________(���������С�����䡱)��
(3)��֪100��ʱˮ�����ӻ�Kw��1.0��10-12��100 ��ʱ����pH=9��NaOH��Һ��pH=4��������Һ��ϣ������û����ҺpH=7����NaOH��Һ��������Һ�������Ϊ___________
��4��25 ���ڵ�����Ģ�pH=0��H2SO4��Һ���� 0.05 mol��L��1��Ba(OH)2��Һ����pH = 10��Na2S��Һ����pH=5��NH4NO3��Һ�У����������ˮ�����ʵ���֮����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�����ܱ������У����淴ӦA(s)  B��C(g)��Q�ﵽƽ�⡣��С������������´ﵽƽ��ʱ��C(g)��Ũ������С���ǰ��ƽ��Ũ����ȡ����·�����ȷ����
B��C(g)��Q�ﵽƽ�⡣��С������������´ﵽƽ��ʱ��C(g)��Ũ������С���ǰ��ƽ��Ũ����ȡ����·�����ȷ����
 A������B��״ֻ̬��Ϊ��̬��Һ̬
A������B��״ֻ̬��Ϊ��̬��Һ̬
B��ƽ��ʱ����λʱ����n(A)���ġ�n(C)���ģ�1��1
C������������䣬��ƽ����ϵ�м���A��ƽ��������Ӧ�����ƶ�
D������ʼʱ�������м���1 mol B��1 mol C���ﵽƽ��ʱ�ų�����Q
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ�������ֵ������˵������ȷ���ǣ� ��
A��1 mol NH4+ ����������Ϊ10NA
B��CO2��Ħ������Ϊ44 g
C�����³�ѹ�£�32 g O2��O3�Ļ����������ԭ����Ϊ2NA
D����״���£�22.4 LHCl����ˮ�γ�1L��Һ��������Һ�����ʵ����ʵ���Ũ��Ϊ22.4 mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com