
| |||||||||||
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试化学(上海卷带解析) 题型:实验题
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的氢溴酸500ml,所需的玻璃仪器有玻璃棒、 。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 、 。
(3)试剂b是 ,步骤Ⅳ的目的是 。
(4)步骤Ⅴ所含的操作依次是 、 。
(5)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤;④ ;⑤称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
若实验操作规范而测定结果偏低,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省高三联合考试理综化学试卷(解析版) 题型:填空题
溴化钙(CaBr2·2H2O)是一种白色晶体,易溶于水,有很强的吸湿性,是光敏纸矿泉水和灭火剂的重要成分,在医药上用作治疗神经衰弱等的药物,也用作化学分析。用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下

回答下列问题
(1)溶解时发生的主要反应的离子方程式为
(2)除杂步骤控制溶液的pH约为8.0的目的是 ,
(3)滤液用氢溴酸酸化的目的是 ,操作a主要包括 , 和过滤
(4)制得的溴化钙晶体可以通过如下步骤测定其纯度:
①称取5.00g溴化钙晶体样品,②溶解;③滴入足量Naa2CO3溶液,充分反应后过滤,④烘干、冷却;⑤称量。若得到2. 00 g碳酸钙,则样品的纯度为
(5)溴化钙晶体中溴离子和钙离子的检验
①将少量溴化钙晶体溶于水,加入硝酸酸化的AgNO3溶液,实验现象为 ,发生反应的离子方程式为
②将少量溴化钙晶体溶于水,滴加草酸钠溶液,实验现象为 ,发生反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
(09盐城第三次调研)CaO2?8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室先用大理石(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙。实验流程如下(已知:Ca(OH)2+H2O2+6H2O→CaO2?8H2O △H<0):
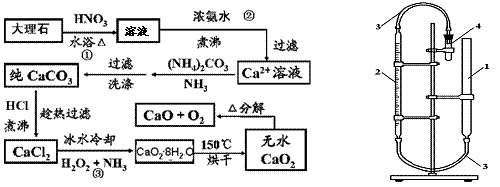
(1)写出CaO2的电子式: 。
(2)图示步骤②,加入浓氨水至弱碱性的目的是: 。
(3)步骤③发生反应的化学方程式为: 。
(4)步骤③用冰水冷却的可能原因是: 。
(5)用右上图的量气法可测定样品中CaO2的质量分数:先检查装置的气密性,然后在量气管中注入一定量的水,在仪器4的试管中注入9.0g样品,连接好装置;充分加仪器4所示的小试管。若在标准状况下收集到840mL气体,则CaO2纯度为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com