
【题目】以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能即为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)基态镓原子的价电子排布式为___。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为__和+3。砷的电负性比镓__(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,GaCl3、GaBr3、GaI3的熔、沸点依次升高,分析其变化原因:__。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是__。
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:___。
②反应物AsH3分子的几何构型为__,(CH3)3Ga中镓原子杂化方式为__。
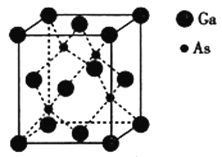
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,As的配位数为__,晶体的密度为__(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
【答案】4s24p1 +1 大 GaCl3、GaBr3、GaI3均为分子晶体,结构相似,相对分子质量依次增大,分子间作用力依次增强 GaF3为离子晶体 (CH3)3Ga+AsH3![]() GaAs+3CH4 三角锥形 sp2 4
GaAs+3CH4 三角锥形 sp2 4 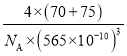
【解析】
(1)基态镓原子的电子排布式为1s22s22p63s23p63d104s24p1,则其价电子排布式为4s24p1。答案为:4s24p1;
(2)镓的第一电离能比第二电离能要小得多,由此可推知镓的主要化合价为+1价。砷的价电子排布式为4s24p3,镓的价电子排布式为4s24p1,则二者同周期且砷在镓的右边,电负性砷大。答案为:大;
(3)镓的卤化物的熔点都比较低,则应形成分子晶体,GaCl3、GaBr3、GaI3的沸点依次升高,其变化原因是GaCl3、GaBr3、GaI3均为分子晶体,结构相似,相对分子质量依次增大,分子间作用力依次增强。答案为:GaCl3、GaBr3、GaI3均为分子晶体,结构相似,相对分子质量依次增大,分子间作用力依次增强;
GaF3的相对分子质量最小,但其熔点超过1000℃,则不适合用分子晶体解释,可能的原因是GaF3为离子晶体。答案为:GaF3为离子晶体;
(4)①在700℃时,(CH3)3Ga和AsH3反应,生成GaAs等,反应的方程式为(CH3)3Ga+AsH3![]() GaAs+3CH4。答案为:(CH3)3Ga+AsH3
GaAs+3CH4。答案为:(CH3)3Ga+AsH3![]() GaAs+3CH4;
GaAs+3CH4;
②反应物AsH3分子的几何构型与NH3类似,则为三角锥形,(CH3)3Ga中镓原子的价层电子对数为3,且无孤对电子,由此可得出杂化方式为sp2。答案为:三角锥形;sp2;
(5)从晶胞结构图中可以看出,As周围有4个Ga原子,则配位数为4。1个晶胞中含有4个GaAs,由此可求出1个晶胞的质量,再由晶胞参数,即可求出晶胞的体积,从而求出晶体的密度为![]() =
=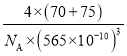 g·cm-3。
g·cm-3。
答案为:4;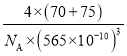 。
。


科目:高中化学 来源: 题型:
【题目】设阿佛加德罗常数为NA,下列叙述正确的是
A.1molD2O所含质子数为12NA;B.1molNa2O2与足量水反应转移电子数为2NA;
C.10g 氖气所含原子数为0.5NA;D.标况下22.4L正戊烷含氢原子数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应5H2O + 3BrF3 = Br2 + O2↑+ HBrO3 + 9HF中,当有45克水被氧化时,被水还原的BrF3的物质的量是( )
A. 5/3 mol B. 5/2 mol C. 3/2 mol D. 4/3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下水的离子积常数Kw=1.0×10-14,在100℃时水的离子积常数Kw=1.0×10-12。将常温下的下列溶液加热至100℃(忽略溶液体积变化),溶液的pH不变的是( )
A.Na2SO4溶液B.稀H2SO4溶液C.NaOH溶液D.HCl的浓溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是( )
A. 已知氟利昂12的结构式为![]() ,该分子是平面形分子
,该分子是平面形分子
B. 1mol苹果酸[HOOCCH(OH)CH2COOH]可与3molNaHCO3发生反应
C. 用甲苯分别制取TNT、邻溴甲苯所涉及的反应均为取代反应
D. ![]() 的一氯代物共有5种(不考虑立体异构)
的一氯代物共有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)CO2(g)+Cu(s)和反应②H2(g)+CuO(s)Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K3。则下列说法中正确的是( )
A.反应①的平衡常数K1=![]()
B.反应③的平衡常数K3=![]()
C.对于反应③,恒容时,温度升高,氢气的浓度减小,则该反应的ΔH > 0
D.对于反应②,增加CuO的量,平衡正移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,原子最外层电子数之和为17。其中W、X、Y三种元素的简单离子的核外电子排布相同,且可形成结构如图所示的化合物。下列说法正确的是( )
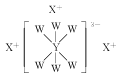
A.原子半径:Z>Y>X>W
B.X与Z形成的化合物会抑制水的电离
C.X、Z均能形成两种常见氧化物
D.W的最高价氧化物对应水化物的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的
a电极 | b电极 | x电极 | Z溶液 | |
A | 铜 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
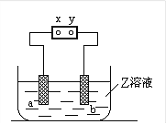
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧气是一种清洁能源,氧气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=206.2 kJ![]()
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=247.4 kJ![]()
2H2S(g)=2H2(g)+S2(g)ΔH=169.8 kJ![]()
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4与 H2O(g)反应生成CO2(g)和 H2(g)的热化学方程式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com