
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。
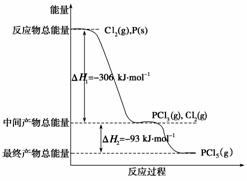
根据上图回答下列问题:
(1) P和Cl2反应生成PCl3的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
(2) PCl5分解成PCl3和Cl2的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80 mol PCl5,反应达到平衡时PCl5还剩0.60 mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是
________________________________________________________________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=______,P和Cl2一步反应生成1 mol PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
________________________________________________________________________。
答案 (1) Cl2(g)+P(s)===PCl3(g)
Cl2(g)+P(s)===PCl3(g)
ΔH=-306 kJ·mol-1
(2)PCl5(g)===PCl3(g)+Cl2(g)
ΔH=93 kJ·mol-1 25% 大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ·mol-1 等于
(5)PCl5+4H2O===H3PO4+5HCl
解析 (1)产物的总能量减去反应物的总能量就等于反应热,结合图象可知,PCl3和反应物P和Cl2的能量差值为306 kJ,因此该热化学反应方程式为
P(s)+ Cl2(g)===PCl3(g) ΔH=-306 kJ·mol-1。
Cl2(g)===PCl3(g) ΔH=-306 kJ·mol-1。
(2)根据图象可知PCl5和PCl3之间的能量差值为93 kJ,因此PCl5分解成PCl3和Cl2的热化学方程式为PCl5(g)===PCl3(g)+Cl2(g) ΔH=93 kJ·mol-1。加入0.80 mol PCl5,剩余0.60 mol,因此PCl5的分解率为 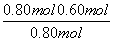 ×100%=25%,由于该反应ΔH>0即为吸热反应,因此升高温度,平衡右移,故α2>α1。
×100%=25%,由于该反应ΔH>0即为吸热反应,因此升高温度,平衡右移,故α2>α1。
(3)由于两个反应都是放热反应,降低温度有利于平衡右移,提高产率。同时由于PCl5受热易分解,因此温度低防止其分解。
(4)根据盖斯定律求得:ΔH3=-399 kJ·mol-1。且ΔH3=ΔH4,与反应的途径无关,只与起始物质、终了物质有关。
(5)PCl5和水发生反应,生成两种酸只能是H3PO4和HCl,其化学方程式是 PCl5+4H2O===H3PO4+5HCl。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
下列有机物的命名正确的是( )
A.2,2二甲基3丁烯
B.2,3二甲基3乙基丁烷
C.3,3,5,5四甲基己烷
D.2甲基1,3丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述中,不正确的是
( )。
A.植物油能使溴的四氯化碳溶液褪色
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生水解反应
D.所有的蛋白质遇浓硝酸均变黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
叠氮酸钠(NaN3)是抗甲型H1N1流行感冒药物“达菲”合成过程中的中间活性物质。
(1)NaN3中存在的化学键有________。(答案可能不止一个)
a.离子键
b.极性共价键
c.非极性共价键
(2)3 mol NaN3受撞击会生成4 mol氮气和1 mol离子化合物A,可用于汽车保护气囊。请写出:
①有关反应的化学方程式:___________________________________。
②A的电子式___________________________________________________。
(3)写出与N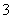 是等电子体的物质的化学式________(两种),等电子体的微粒往往具有相似的结构,试预测N
是等电子体的物质的化学式________(两种),等电子体的微粒往往具有相似的结构,试预测N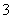 的构型________。
的构型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+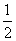 O2(g) ΔH=-226 kJ·mol-1
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
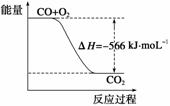
A.CO的燃烧热为283 kJ
B.如图可表示为CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于物理变化的是( )
A.麦芽糖和稀硫酸共热
B.蛋白质溶液中加入饱和NaCl溶液,有固体析出
C.蛋白质溶液中加入浓NaOH溶液
D.氨基酸中加入盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
吗丁啉是一种常见的胃药,其有效成分的结构简式如下图所示。
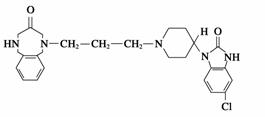
下列关于该物质的说法中正确的是( )
A.该物质属于芳香烃
B.该物质的相对分子质量很大,属于高分子化合物
C.该物质可以发生水解反应和取代反应
D.该物质是一种蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳的物质的量之比为1∶1,由此可以得出的结论是( )
A.该有机物分子中C、H、O原子个数比为1∶2∶1 B.分子中C、H原子个数比为1∶2
C.该有机物必定含氧 D.可判断该有机物是否含氧
查看答案和解析>>
科目:高中化学 来源: 题型:
分别取1 mol葡萄糖进行下列试验:
(1)银镜反应时,生成Ag的物质的量为________mol,反应后葡萄糖变为__________________,其结构简式是_____________________________。
(2)与乙酸反应生成酯,从理论上讲完全酯化需要________g乙酸。
(3)若使之完全转化为CO2和H2O,所需氧气的体积在标准状况下为________L,反应的化学方程式是____________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com