
| A、原子半径:A<B<C |
| B、C的最简单氢化物的稳定性大于A的最简单氢化物的稳定性 |
| C、高温下,A单质能置换出C单质 |
| D、三种元素的最高价氧化物对应的水化物均可由化合反应得到 |


科目:高中化学 来源: 题型:
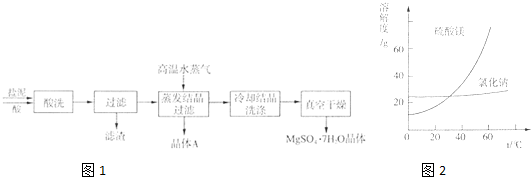
| ||
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
| B、100ml 0.1mol/L FeI2溶液与标况下0.224L Cl2:2Fe2++Cl2═2Fe3++2Cl- | ||||
C、NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
| ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.05 mol?L-1 |
| B、0.25 mol?L-1 |
| C、0.10 mol?L-1 |
| D、0.50 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、①④ | D、②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
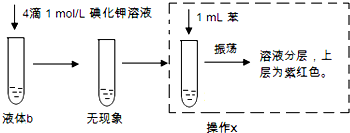 据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.
据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com