
【题目】一块表面已被氧化成氧化钠的钠块(质量为5.4 g)投入足量的水中,产生标准状态下的H2 1.12 L,则原来被氧化的钠的质量为
A.5.3gB.4.6 gC.3.1 gD.2.3 g
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COOO-+C2H5OH两种反应物的初始浓度均为0.050mol/L,在不同温度下测得O2NC6H4COOC2H5的浓度(mol/L)随时间变化的数据如下表所示。下列有关说法不正确的是( )
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
15℃ | 0.500 | 0.335 | 0.291 | 0.256 | 0.210 | 0.155 | 0.148 | 0.145 | 0.145 |
35℃ | 0.500 | 0.325 | 0.2775 | 0.238 | 0.190 | … | 0.135 | 0.135 | 0.135 |
A. 该反应在![]() ,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
B. 由数据可知,随着反应的进行,反应物的浓度降低,反应速率减慢
C. 530s时,表格中35℃对应的数据一定是0.135
D. 由数据可知,温度升高反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种性能非常优越的金属,21世纪将是钛的世纪。
(1)TiO2薄膜中掺杂铬能显著提高光催化活性。基态Cr原子的核外电子排布式为____。
(2)四乙醇钛能增加橡胶在金属表面的粘附性。其制备原理如下:TiCl4+4CH3CH2OH+4NH3=Ti(OCH2CH3)4+4NH4Cl
①Ti(OCH2CH3)4可溶于有机溶剂,常温下为淡黄色透明液体,其晶体类型为____
②N和O位于同一周期,O的第二电离能大于N的第二电离能的原因是_____;
③NH4Cl中存在的作用力有_____,NH4Cl熔沸点高于CH3CH2OH的原因是_____,Ti(OCH2CH3)4分子中C原子的杂化形式均为 ____。
(3)钛酸锶(SrTiO3)可作电子陶瓷材料和人造宝石,其中一种晶胞结构如图所示。若Ti位于顶点位置,O位于____位置;已知晶胞参数为a nm,Ti位于O所形成的正八面体的体心,则该八面体的边长为_____ m(列出表达式)。
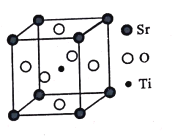
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是( )
实验 | 现象 | 结论 | |
A | 向 | 黄色逐渐消失,加 | 还原性: |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
|
C | 向某溶液中先加入氯水,再加入 | 加入 | 最初溶液中含有 |
D | 向2支盛有 | 两只试管中固体均溶解 | 氧化铝是两性氧化物 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,蕴含着丰富的化学元素,如钠、镁、氯、溴等。
(1)写出电解饱和食盐水的离子方程式__________________;
(2)对水进行处理时,可加入明矾除去水中的悬浮颗粒,用离子方程式表示反应原理__________________;
(3)漂白粉可以对自来水进行杀菌消毒,写出工业上用石灰乳制漂白粉的化学方程式__________________;当![]() 氯气参与反应时,转移电子数为______。
氯气参与反应时,转移电子数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用如图装置对电解质溶液导电性进行实验探究。下列说法中正确的是( )
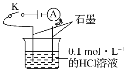
A.闭合开关K,电流表指针发生偏转,证明HCl溶液是电解质
B.闭合开关K,向烧杯中加入NaCl固体,由于HCl与NaCl不反应,故电流表指针不发生变化
C.闭合开关K,向溶液中加入CaCO3固体,电流表示数不变
D.选取相同质量分数的硫酸替换HCl溶液,电流表的示数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示。
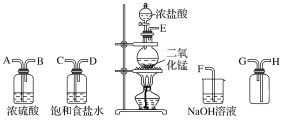
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接___;__接__。
(2)装置中,饱和食盐水的作用是___;NaOH溶液的作用是___。
(3)化学实验中常用湿润的KI-淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到___,反应的化学方程式为___。
(4)写出下列反应的化学方程式:
①气体发生装置中进行的反应:___。
②NaOH溶液中发生的反应:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g)![]() CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了![]() 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。
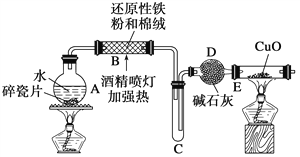
(1)硬质玻璃管B中发生反应的化学方程式为_______________________________。
(2)反应前A中投放碎瓷片的目的是____________________。
(3)装置E中的现象是__________________________________。
探究二 FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法正确的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
实验步骤、预期现象 | 结论 |
①向溶液中加入__________,振荡、静置, 现象:下层呈橙红色,上层呈无色 | 假设1正确 |
②向溶液中加入_____________ 现象:溶液变为红色 | 假设2正确 |
若假设1正确,从实验①中分离出Br2的实验操作名称是_______________ 。
(4)已知:Br2+2Fe2+=2Fe3++2Br-。若在50mL上述FeBr2溶液中通入标准状况112mlCl2,反应的离子方程式为__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com