
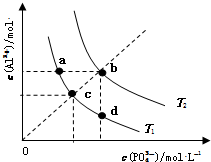
| A. | 图象中四个点的Ksp:a=b>c>d | B. | AlPO4在b点对应的溶解度大于c点 | ||
| C. | AlPO4(s)→Al3+(aq)+PO43-(aq)△H<0 | D. | 升高温度可使d点移动到b点 |
分析 A.温度相同,Ksp相同,温度越高,Ksp越大;
B.T2>T1,温度高时溶解度大;
C.沉淀溶解平衡为吸热反应;
D.升高温度,沉淀溶解平衡正向移动.
解答 解:A.温度相同,Ksp相同,温度越高,Ksp越大,则图象中四个点的Ksp:a=d=c<b,故A错误;
B.T2>T1,温度高时溶解度大,则AlPO4在b点对应的溶解度大于c点,故B正确;
C.沉淀溶解平衡为吸热反应,则AlPO4(s)→Al3+(aq)+PO43-(aq)△H>0,故C错误;
D.升高温度,沉淀溶解平衡正向移动,则升高温度Al3+、PO43-的浓度均增大,不能使d点移动到b点,故D错误;
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握图象分析、Ksp与温度有关、沉淀溶解平衡为吸热反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 渗析、蒸馏、萃取 | B. | 分液、萃取、蒸馏 | C. | 过滤、分液、聚沉 | D. | 过滤、分液、渗析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始浓度(mol/L) | 1.5 | 1.0 | 0 |
| 2s末浓度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
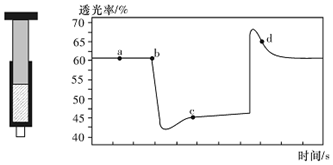
| A. | b点的操作是拉伸注射器 | |
| B. | d点:v(正)>v(逆) | |
| C. | c点与a点相比,c(N02)增大,c(N204)减小,若容器绝热则平衡常数Ka>Kc | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由“c(石墨)=c(金刚石)△H=+1.9KJ/mol”可知,金刚石没有石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H1,CH3COOH(aq)+OH-(aq)═H2O(l)+CH3COO-(aq)△H2,则△H1>△H2 | |
| D. | 在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=285.8KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com