
【题目】过氧化钙主要用作杀菌剂、防腐剂等,温度在350℃以上容易分解。某同学在实验室中利用纯氧制取少量CaO2,其装置示意图如图:
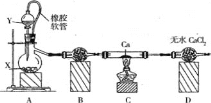
回答下列问题:
(1)制备氧气的方法有多种,若X是MnO2,则Y 是____,若Y是H2O,则A中反应的化学方程式为__。
(2)使用橡皮软管的好处是_____, B中试剂是______.
(3)实验结束时,该同学取少量C中固体置于水中,发现有一种刺激性气味的气体且该气体遇石蕊试液变蓝色,则该气体成分是_______。
(4)为测量产品的纯度,该同学准确称量8.00g产品,然后溶解在足量的KI酸性溶液中,充分反应后再取上述溶液总量的一半,用0.2000 mol·L-1Na2S2O3溶液滴定(I2+2Na2S2O3 =2NaI+Na2S4O6,指示剂为淀粉),滴定终点时消耗了VmL标准溶液。判断滴定 达到终点时的依据是__________,产品中CaO2纯度为________%。
【答案】H2O2 2Na2O2+2H2O=4NaOH+O2↑ 平衡压强,使分液漏斗中的液体顺利滴下 无水CaCl2或碱石灰 NH3 溶液蓝色消失且在30s内不恢复蓝色 0.18V
【解析】
(1)装置A用于制备氧气,当X是MnO2时,Y是H2O2;当Y是水时,X是Na2O2;
(2)平衡压强,使分液漏斗中的液体顺利滴下;由于过氧化物易与水反应,故装置B是干燥装置;
(3) Ca可能会和空气中氮气生成氮化钙,氮化钙溶于水产生氨气,由气体性质知其是NH3;(4)酸性溶液中CaO2将KI氧化为I2,滴定中I2又被还原为I-。
(1)装置A用于制备氧气,当X是MnO2时,Y是H2O2;当Y是水时,X是Na2O2;
(2)橡胶软管可将分液漏斗与烧瓶连接起来,从而可以平衡压强,使分液漏斗中的液体顺利滴下;由于过氧化物易与水反应,故装置B是干燥装置,试剂为无水CaCl2或碱石灰;
(3) Ca可能会和空气中氮气生成氮化钙,氮化钙溶于水产生氨气,由气体性质知其是NH3;(4)酸性溶液中CaO2将KI氧化为I2,滴定中I2又被还原为I-,终点颜色变化为溶液蓝色消失且在30 s内不恢复蓝色。由前面的分析知,CaO2~I2~2Na2S2O3。故4.00 g样品中n(CaO2)=1×10-4V mol,质量为0.0072V g,质量分数为0.18V%。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍,B在D的单质中充分燃烧能生成其最高价化合物BD2,E+与D2-具有相同的电子数。A在F是单质中燃烧,产物溶于水得到一种强酸。下列有关说法正确的是( )
A.工业上F单质用MnO2和AF来制备
B.B元素所形成的单质的晶体类型都是相同的
C.F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B
D.由化学键角度推断,能形成BDF2这种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
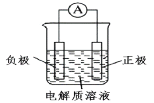
【题目】原电池原理应用广泛。
(1)利用原电池装置可以验证Fe3+与Cu2+氧化性相对强弱。
如图所示,该方案的实验原理是自发进行的氧化还原反应可以设计为原电池。写出该氧化还原反应的离子方程式:__________________________,装置中的负极材料是______(填化学式),正极反应式是_________________________。
(2)某研究性学习小组为证明2Fe3++2I-![]() 2Fe2++I2为可逆反应,设计如下方案:组装如图原电池装置,接通灵敏电流计,指针向右偏转(注:此灵敏电流计指针是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右管中加入1mol/LFeCl2溶液。
2Fe2++I2为可逆反应,设计如下方案:组装如图原电池装置,接通灵敏电流计,指针向右偏转(注:此灵敏电流计指针是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。当指针读数变零后,在右管中加入1mol/LFeCl2溶液。
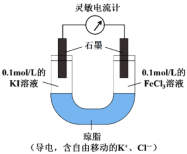
①实验中,“读数变为零”是因为___________________。
②“在右管中加入1mol/LFeCl2溶液”后,观察到灵敏电流计的指针_________偏转(填“向左”、“向右”或“不”),可证明该反应为可逆反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,含A元素的物质灼烧时会发出明亮的黄色火焰;B为紫红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射。根据以上信息回答下列问题:
(1)写出对应化学式:A________,B________,C________,D________。
(2)B锈蚀时生成的绿色物质的主要成分是________,D在氧气中燃烧生成的氧化物为________。
(3)写出下列反应方程式:
①A的碳酸氢盐受热分解的化学方程式______________________________________;
②C单质与烧碱溶液反应的离子方程式______________________________________;
③B与D的三价盐溶液反应的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2V L含有Na2SO4和MgSO4的混合溶液分成两等份,一份加入含溶质a mol的KOH溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含溶质b mol的BaCl2溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钠离子的浓度为
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1C.
mol·L-1C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法不正确的是( )
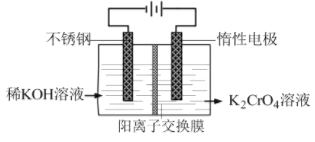
A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+![]() Cr2O72-+H2O向右移动
Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O![]() 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为1-0.5d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中26 Al和10 Be两种元素的比例来确定“北京人”的年龄,这种测量方法叫铝铍测年法。下列关于26 Al和10 Be的说法不正确的是( )
A.5.2g 26 Al3+中所含的电子数约为1.204×1024
B.10 Be和9 Be是中子数不同、质子数相同的不同原子
C.26 Al3+和26 Mg2+的质子数、中子数和核外电子数都不相同
D.10 Be原子核内的中子数比质子数多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )

A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、N、X、Y四种物质有如下转化关系(反应条件和其他产物已省略),下列选项不可能的是( )
![]()
A.M:Na X:O2
B.M:HNO3X:Fe
C.M:Al X:NaOH
D.M:NH3X:O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com