
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Fe2+、NO3- | D. | Na+、Cu2+、Cl-、SO42- |
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeCl3溶液中,Fe3+的物质的量一定小于0.1NA | |
| B. | 6.6gCO2分子中含的共用电子对数为0.6NA | |
| C. | 标准状况下,22.4LNO和11.2L02混合后气体的分子总数为NA | |
| D. | 6.4g铜与足量的硫充分反应,则转移的电子教为0.2N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NH4Cl溶液 | B. | 0.1 mol•L-1NaCl溶液 | ||
| C. | 0.1 mol•L-1氨水 | D. | 0.1 mol•L-1 NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K +、SiO32-、OH -、Na + | B. | Na +、H +、CO32-、SO42- | ||
| C. | K +、H +、SiO32-、Cl - | D. | OH -、Na +、HCO3-、Cl - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和食盐水、浓硫酸 | B. | NaOH溶液、浓硫酸 | ||
| C. | NaHCO3溶液、硅胶 | D. | 浓盐酸、碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
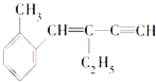 ,下列结论正确的是( )
,下列结论正确的是( )| A. | 该有机物分子式为C13H16,属于苯的同系物 | |
| B. | 1mol该有机物分子与溴水加成最多消耗5molBr2,与氢气加成最多消耗5molH2 | |
| C. | 该有机物分子至少有4个碳原子共直线,最多有13个碳原子共平面 | |
| D. | 一定条件下.该有机物可发生取代、加成和氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com