
当CH3COOH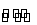 H++CH3COO-已达平衡,若要使醋酸的电离度和溶液的pH都减小,应加入的试剂是( )
H++CH3COO-已达平衡,若要使醋酸的电离度和溶液的pH都减小,应加入的试剂是( )
A.CH3COONa B.NH3·H2O C.HCl D.H2O
科目:高中化学 来源: 题型:
下列有关物质变化的说法正确的是( )
A.熔融态的Al2O3导电、12C转化为14C都属于化学变化
B.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类
C.用热的纯碱溶液洗涤沾有油污的器具时涉及化学变化和物理变化
D.将盛有NO2气体的密封烧瓶,放入热水中气体颜色加深的变化是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉质量减少,则该盐不可能是( )
A.FeC13 B.NaC1 C.KNO3 D.Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
部分被氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
下列说法正确的是( )
A.滤液A中的阳离子为Fe2+、Fe3+、H+
B.样品中铁元素的质量为2.24 g
C.样品中CuO的质量为4.0 g
D.V=896 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
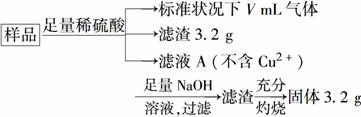
(1)实验室用锌片和稀硫酸反应制取氢气,并验证氢气的还原性及回收硫酸锌晶体。
①各仪器的连接顺序为__________,装置E中盛放的试剂为__________,装置C的作用是________________________。
②锌与硫酸反应制取氢气后的剩余废液中,常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从BaCl2溶液、Zn粉、NaOH溶液三种试剂中选用一种试剂除杂并简述回收硫酸锌晶体的实验过程______________________________。
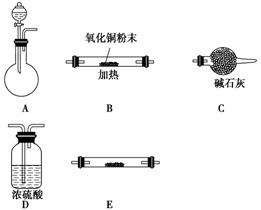
(2)工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.7、6.5、9.7。
①为了提高酸浸效率,可以采取的措施有__________________(写出两条即可)。
②加入适量锌粉的作用为________________。
③氧化过程中H2O2发生反应的离子方程式为______________________________。
④由滤液得到ZnSO4·7H2O的操作依次为__________、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.pH<7的溶液不一定是酸溶液
B.常温下,pH=5的溶液和pH=3的溶液相比,前者[OH-]不一定是后者的100倍
C.室温下,每1×107个水分子中只有一个水分子发生电离
D.在1 mol·L-1的氨水中,改变外界条件使[NH4+]增大,则溶液的pH一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
在 某温度时,测得纯水中[H+]=2.0×10-7 mol·L-1,则[OH-]为( )
某温度时,测得纯水中[H+]=2.0×10-7 mol·L-1,则[OH-]为( )
A.2.0×10-7 mol·L-1
B.0.1×10-7 mol·L-1
C.1.0×10-14/2.0×10-7 mol·L-1
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
反应2C+O2===2CO的能量变化如图所示。下列说法正确的是( )
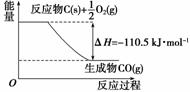
A.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ
B.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
C.该反应的热化学方程式是2C(s)+O2(g)===2CO(g)
ΔH=-221 kJ
D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:ClO-+Cl-+2H+=Cl2↑+H2O。下列说法正确的是 ( )
A.符合该离子方程式的化学方程式可以是:HClO+HCl= Cl2↑+H2O
B.标准状况下,每生成1.12L Cl2,转移0.05NA电子
C.在无色碱性溶液中,ClO-、Cl-、Al3+、Na+能大量共存
D.洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用效果更好、更安全
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com