
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
设nA为阿伏加德罗常数的数值,下列说法正确的是( )
A.常温常压下,8 g O2含有4nA个电子
B.1 L 0.1 mol·L-1的氨水中有nA个NH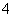
C.标准状况下,22.4 L盐酸含有nA个HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
有0.1mol·L-1的三种溶液:①CH3COOH ②NaOH ③CH3COONa,下列说法正确的是( )
A.溶液①中,c(CH3COO-)=c(H+)
B.溶液①②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C.溶液①②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D.溶液①③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3酸性溶液脱除H2S后的溶液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是___________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应的方程式:__________________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol/L。
②Ⅳ中检验Cl2的实验方法___________________________。
③与Ⅱ对比,得出的结论(写出两点)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
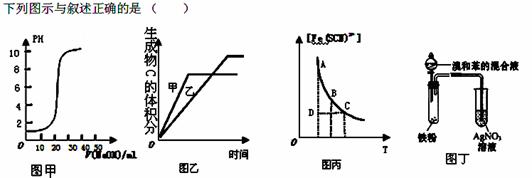
A.图甲表示用0.1000mol/L的NaOH溶液滴定20.00ml,0.1000mol/L的醋酸溶液得到的滴定曲线
B.图乙表示压强对可逆反应2A (g)+ B (g) 3C (g)+D (s)的影响且甲的比乙的压强大
3C (g)+D (s)的影响且甲的比乙的压强大
C.图丙表示可逆反应Fe3+(aq)+SCN—(aq) Fe(SCN)2+(aq)平衡时,物质的量浓度
Fe(SCN)2+(aq)平衡时,物质的量浓度
[Fe(SCN) 2+]与温度T的关系,反应处于D点时,一定有V(正)>V(逆)
D.图丁所示装置可证明溴与苯发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2<Q3 B. Q2 > Q1 >Q3 C. Q3> Q2> Q1 D. Q1=Q2=Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定体积的密闭容器中,加入2molA和1molB,发生反应:
2A(气) + B(气)  3C(气) + D(气)
3C(气) + D(气)
达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
A. 4molA+2molB B. 2molA+1molB+3molC+1molD
C. 3molC+1molD+1molB D. 3molC+1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应
PH4I(S) PH3(g) + HI(g) ① ;
4PH3(g) P4(g)+ 6 H2(g) ② ;
2HI(g) H2(g) + I2(g) ③
以上三反应建立平衡后,测得HI为b mol,I2(气)为c mol,H2为d mol。求:
⑴ 平衡后,容器内P4(气)和PH3的物质的量(用代数式表示):n(P4)= ,n(PH3)= 。
⑵ a,b,c三者的关系服从a > (填含b,c的代数式)。
⑶ 平衡后,增大压强,容器内n(I2) , n(PH4I) (增加、减少、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式中,正确的是( )
A.向NaOH溶液中加入少量Mg(HCO3)2溶液:2OH-+Mg2+===M g(OH)2↓
g(OH)2↓
B.向足量NaHSO4溶液中逐渐滴入Ba(HCO3)2溶液:HCO +Ba2++H++SO
+Ba2++H++SO ===BaSO4↓+H2O+CO2↑
===BaSO4↓+H2O+CO2↑
C.酸性KMnO4溶液与H2O2反应:2MnO +10H++3H
+10H++3H 2O2===2Mn2++3O2↑+8H2O
2O2===2Mn2++3O2↑+8H2O
D.向Fe(NO3)3溶液中加入过量HI溶液:Fe3++3NO +12H++10I-===Fe2++3NO↑+5I2+6H2O
+12H++10I-===Fe2++3NO↑+5I2+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com