
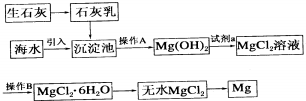
分析 由流程可知,生石灰溶于水生成氢氧化钙,加入海水中沉淀镁离子生成氢氧化镁沉淀,操作A为过滤,过滤后加入试剂a为盐酸,反应得到氯化镁溶液,操作B为蒸发浓缩冷却结晶,得到氯化镁晶体,因氯化镁水解生成的盐酸易挥发,则在氯化氢气流中加热失去结晶水得到氯化镁固体,最后电解熔融氯化镁得到金属镁,以此来解答.
解答 解:由流程可知,生石灰溶于水生成氢氧化钙,加入海水中沉淀镁离子生成氢氧化镁沉淀,操作A为过滤,过滤后加入试剂a为盐酸,反应得到氯化镁溶液,操作B为蒸发浓缩冷却结晶,得到氯化镁晶体,因氯化镁水解生成的盐酸易挥发,则在氯化氢气流中加热失去结晶水得到氯化镁固体,最后电解熔融氯化镁得到金属镁,
(1)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度考虑,生产生石灰的主要原料来源于海洋中的贝壳(或牡蛎壳等),其生产方程式为CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.从离子反应的角度思考,往海水中加入石灰乳的作用是沉淀Mg2+,
故答案为:贝壳(或牡蛎壳等);CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;沉淀Mg2+;
(2)由上述分析可知,操作A是过滤,操作B是蒸发浓缩、冷却结晶,故答案为:过滤;蒸发浓缩、冷却结晶;
(3)由氢氧化镁转化为氯化镁可知,试剂a为HCl,故答案为:HCl;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,从考虑成本和废物循环利用的角度,副产物氯气可以用于制盐酸,氯气可用于水的消毒、制取漂白粉等,
故答案为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;制盐酸,循环使用.
点评 本题考查混合物分离提纯,为高频考点,把握分离流程中的反应、混合物分离方法为解答本题的关键,侧重分析与实验能力的考查,注意海水资源应用及元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>R>Z | |
| B. | W的气态氢化物的热稳定性比Y的强 | |
| C. | Z与W形成的是离子化合物 | |
| D. | W的最高价氧化物对应水化物酸性比R的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定有甲烷和乙烯 | ||
| C. | 混合气体中一定有乙炔 | D. | 混合气体中一定没有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | VA=3.0mol•L-1•min-1 | B. | VB=0.2mol•L-1•s-1 | ||
| C. | VC=4.8mol•L-1•min-1 | D. | VD=4.0mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该氢化物可以与H+离子以配位键相合,产物的结构式
,该氢化物可以与H+离子以配位键相合,产物的结构式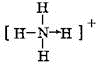 .
. ,1mol O22+中含有的π键为2mol.
,1mol O22+中含有的π键为2mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com