
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其他操作正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 | |
| D. | 滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 |
分析 先分析不当操作对消耗的标准溶液体积的影响,再根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$分析判断.
解答 解:A.配制标准溶液的NaOH中混有Na2CO3杂质,以酚酞为指示剂时等质量的氢氧化钠和Na2CO3消耗的酸前者大,所以标准溶液的氢氧化钠中混有Na2CO3杂质时造成V(碱)偏大,根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$分析,可知c(酸)偏高,故A正确;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确,导致标准液的体积读数偏小,则测定结果偏低,故B错误;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗,操作正确,不会影响测定结果,故C错误;
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,这一滴标准液没有参加反应,又计算在了标准液中,会导致测定结果偏高,故D正确;
故选AD.
点评 本题考查中和滴定的误差分析,若标准溶液的体积偏小,那么测得的物质的量的浓度也偏小;若标准溶液的体积偏大,那么测得的物质的量的浓度也偏大,题目难度不大.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 3n-12 | B. | 3n-6 | C. | 3n-4 | D. | 2n-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
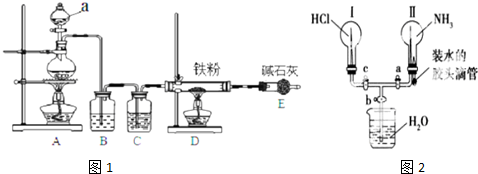
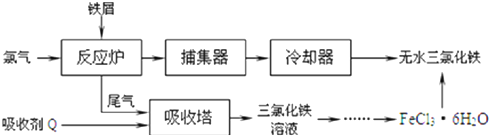
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |
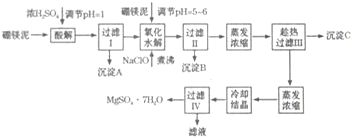
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
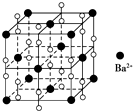
| A. | 该晶体属于离子晶体 | |
| B. | 晶体的化学式为BaO2,所以晶体中阴阳离子个数比1:2 | |
| C. | 若将晶胞中阴阳离子位置互换,其图形依然可以看作该晶体的晶胞结构图 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化合物中呈+2价 | B. | 氢氧化物呈两性 | ||
| C. | 硫酸盐难溶于水 | D. | 镭比钙的金属性强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com