
分析 ①(1)根据n=$\frac{V}{{V}_{m}}$计算混合气体的物质的量,令NO与H2的物质的量分别为xmol、ymol,根据二者物质的量之和与平均摩尔质量列方程计算x、y的值,进而计算NO的体积分数;
(2)NO转化为HNO3,H2中氢原子反应后存在HNO3、H2O中,由①中计算得到NO与H2的物质的量,利用原子守恒计算HNO3、H2O的物质的量,根据氧原子守恒有:2n(O2)+n(NO)=3n(HNO3)+n(H2O),再根据V=nVm计算氧气体积;
②(1)根据电子转移守恒计算金属Al的物质的量,再根据m=nM计算铝箔中金属Al的质量;
根据n=$\frac{m}{M}$计算40.77g铝铵矾晶体的物质的量,利用铝元素守恒计算n(Al2O3);
(2)根据铵根守恒计算n[(NH4)2SO4],再根据m=nM计算m[(NH4)2SO4],根据硫酸根守恒计算n(H2SO4),进而计算m(H2SO4),m(混酸)+m(铝箔)+m[(NH4)2SO4]-m(气体)=m(铝铵矾晶体),据此计算原混酸的质量,再根据质量分数定义计算;
③根据n=$\frac{m}{M}$计算5.1g氧化铝的物质的量,由铝原子守恒n(Al3+)=2n(Al2O3),加入足量的盐酸,固体完全溶解,生成0.1mol气体为二氧化碳,所得溶液中加入足量的NaOH并微热,又生成0.1mol气体为氨气,根据元素守恒计算n(CO32-)、n(NH4+),由电荷守恒与质量守恒判断是否缺少阴离子,据此判断化学式.
解答 解:①(1)混合气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,令NO与H2的物质的量分别为xmol、ymol,则:
x+y=0.1,$\frac{30x+2y}{x+y}$=13.2,联立方程,解得x=0.04,y=0.06,
故NO的体积分数为$\frac{0.04mol}{0.1mol}$=0.4,
故答案为:0.4;
(2)NO转化为HNO3,H2中氢原子反应后存在HNO3、H2O中,由①中计算可知n(NO)=0.04mol、n(H2)=0.06mol,由氮原子守恒可得n(HNO3)=n(NO)=0.04mol,由H原子守恒可知2n(H2)=2n(H2O)+n(HNO3),即0.06mol×2=2n(H2O)+0.04mol,解得n(H2O)=0.04mol,根据氧原子守恒有:2n(O2)+n(NO)=3n(HNO3)+n(H2O),故2n(O2)+0.04mol=3×0.04mol+0.04mol,解得n(O2)=0.06mol,故V(O2)=0.06mol×22.4L/mol=1.344L,
故答案为:1.344L;
②(1)根据电子转移守恒,铝箔中n(Al)=$\frac{0.04mol×(5-2)+0.06mol×2}{3}$=0.08mol,故m(Al)=0.08mol×27g/mol=2.16g,
40.77g铝铵矾晶体的物质的量为$\frac{40.77g}{503g/mol}$=0.09mol,由铝元素守恒可知,2n(Al2O3)+0.08mol=0.09mol,故n(Al2O3)=0.005mol,
故答案为:2.16g;0.005mol;
(2)根据铵根守恒可知n[(NH4)2SO4]=$\frac{0.09mol}{2}$=0.045mol,故m[(NH4)2SO4]=0.045mol×132g/mol=5.94g,根据硫酸根守恒可知n(H2SO4)=0.09mol×2-0.045mol=0.135mol,故m(H2SO4)=0.135×98g,
m(Al2O3)=0.005mol×102g/mol=0.51g,m(混酸)+m(铝箔)+m[(NH4)2SO4]-m(气体)=m(铝铵矾晶体),故m(混酸)+2.16g+0.51g+5.94g-0.1mol×13.2g/mol=40.77g,故m(混酸)=40.77-2.16g-0.51g-5.94g+0.1mol×13.2g/mol=33.48g,故原混酸中硫酸的质量分数为$\frac{0.135×98g}{33.48g}$=0.395,
故答案为:0.395;
③n(Al2O3)=$\frac{5.1g}{102g/mol}$=0.05mol,由氧原子守恒n(Al3+)=2n(Al2O3)=0.1mol,
加入足量的盐酸,固体完全溶解,生成0.1mol气体为二氧化碳,由碳元素守恒n(CO32-)=0.1mol,
所得溶液中加入足量的NaOH并微热,又生成0.1mol气体为氨气,由氮元素守恒可知n(NH4+)=0.1mol,
三种离子的质量为0.1mol×(27g/mol+60g/mol+18g/mol)=10.5g,小于13.9g,少13.9g-10.5g=3.4g,
电荷0.1mol×3+0.1mol>0.1mol×2,由电荷守恒与质量守恒可知,缺少阴离子,缺少的阴离子为OH-,而非SO42-,故n(OH-)=0.1mol×3+0.1mol-0.1mol×2=0.2mol,
沉淀中含Al3+、NH4+、CO32-各0.1mol,OH-为0.2mol,故沉淀的化学式为:NH4Al(OH)2CO3,
故答案为:NH4Al(OH)2CO3.
点评 本题考查化学计算,题目很大,计算量很大,过程复杂,主要考查学生守恒思想的利用,是对学生综合能量的考查,对学生的心理素质由很高的要求,难度很大,为易错题目.


科目:高中化学 来源: 题型:选择题
| A. | 硅是人类将太阳能转换为电能的常用材料 | |
| B. | 单质硅能制造光导纤维并在通信领域应用 | |
| C. | 反应:Si+2NaOH+H2O═Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂 | |
| D. | 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,将浓硫酸慢慢注入盛有水的烧杯,并不断用玻璃棒搅拌 | |
| B. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 将铜丝用盐酸洗涤后,蘸取NaCl溶液,在酒精灯上灼烧观察焰色为黄色证明含有Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
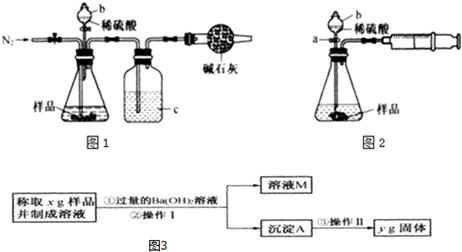
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
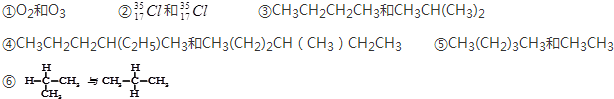
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 页岩气是一种新型的能源,主要成分是甲烷和少量液态烃及CO2,使用页岩气可以有效地降低碳排放量,减少温室效应 | |
| B. | 针对H7N9禽流感的扩散情况,要加强环境、个人等的消毒预防,可选用含氯消毒剂、活性银离子、酒精、双氧水等作为消毒剂,这种处理方法符合绿色化学核心 | |
| C. | 李比希基团理论、逆合成分析理论、范特霍夫对有机化合物结构的三维认识都为有机化学的发展作出贡献 | |
| D. | 石油加工工艺除常见的裂化外,还有催化重整和加氢裂化等工艺,它们都是为了提高汽油等轻质油品质;催化重整还是获得芳香烃的主要途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol单质甲完全燃烧生成的氧化物与热烧碱溶液反应,最多消耗3 mol NaOH,甲的分子结构为正四面体 | |
| B. | 1mol单质乙完全燃烧生成的氧化物与烧碱溶液反应,最多消耗1 mol NaOH,乙的氧化物的熔点较低 | |
| C. | 1mol单质丙完全燃烧生成的氧化物与烧碱溶液反应,最多消耗2 mol NaOH,晶体丙是原子晶体 | |
| D. | 1mol单质丁完全燃烧生成的氧化物与烧碱溶液反应,最多消耗2 mol NaOH,丁可能是良好的半导体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的熔沸点依次升高 | |
| B. | 乙醇分子与水分子之间只存在范德华力 | |
| C. | 甲醇的熔点、沸点大于甲烷是由于甲醇分子之间存在氢键 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com