
分析 100mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.2L×0.5mol/L=0.1mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.1mol×78g/mol=7.8g>3.9g,说明有两种情况:一为氢氧化钠体积较少,沉淀不完全,只生成Al(OH)3沉淀;另一种情况为氢氧化钠体积较多,沉淀完全后又部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:100mL 1mol/L的AlCl3溶液中n(AlCl3)=0.2L×0.5mol/L=0.1mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.1mol×78g/mol=7.8g>3.9g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
n(Al(OH)3)=$\frac{3.9g}{78g/mol}$=0.05mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,NaOH的物质的量为0.05mol×3=0.15mol,加入NaOH溶液的体积为$\frac{0.15mol}{0.5mol/L}$=0.3L=300mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.1mol 0.3mol 0.1mol
Al(OH)3+OH-═AlO2-+2H2O
(0.1-0.05)mol (0.1-0.05)mol
则消耗的碱的物质的量为0.3mol+(0.1-0.05)mol=0.35mol,
加入NaOH溶液的体积为$\frac{0.35mol}{0.5mol/L}$=0.7L=700mL;
答:加入氢氧化钠溶液的体积为300mL或700mL.
点评 本题考查化学方程式的有关计算,难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.


科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH3CH(CH3)2 | C. | C(CH3)4 | D. | CH3CH(CH3)CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
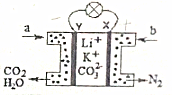 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )| A. | b为空气,电子由X极经导线流向Y极 | |
| B. | 在熔融电解质中,CO32-向X极移动 | |
| C. | 消耗1molCH3OH,消耗氧气分子数目约为3×6.02×1023 | |
| D. | 正极反应式为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
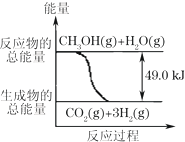 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:| A. | 1molCH3OH完全燃烧放热192.9kJ | |
| B. | 反应①中的能量变化如右图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$ O2(g)→CO2(g)+2H2(g)+Q的Q<192.9kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com