
| ������� | ��ʼʱ�������ʵ���/mol | �ﵽƽ��ʱ��ϵ�����ı仯 | |||
| n��A�� | n��B�� | n��C�� | n��D�� | ||
| �� | 1 | 4 | 0 | 0 | �ų�������32.8kJ |
| �� | 0 | 0 | 1 | 4 | �ų�������Q1 |
| �� | 1 | 1 | 2 | 1 | �ų�������Q2 |
| A�� | ���������з�Ӧ10min�ﵽƽ�⣬0��10minʱ���ڣ���A��ʾ��ƽ����Ӧ����v��A��=4.0��10-2mol/��L•min�� | |
| B�� | ƽ��ʱ�������������A������������ | |
| C�� | �۴�ƽ��ʱ��ϵ�����ı仯��ҪΪ����ת��Ϊ��ѧ�� | |
| D�� | �������У���ʼʱv��B��������v��B������ |
���� A��ƽ��ʱ�ų�������Ϊ32.8 kJ���ʲμӷ�Ӧ��A�����ʵ���$\frac{32.8KJ}{41kJ}$��1mol=0.8mol���ٸ���v=$\frac{��c}{��t}$����v��A����
B�����ڷ�Ӧǰ����������ʵ������䣬��ƽ��ʱ�����١����л�����������ʵ�����Ϊ5mol�������ڵ�ЧΪ��ʼ����1molA��1molBƽ����ټ���3molD��ƽ��ʱA�����ʵ������ڿ�ʼ����1molA��1molB����ƽ��ʱA�����ʵ������������ٵ�ЧΪ��ʼ����1molA��1molB����ƽ����ټ���3molB��ƽ��ʱA�����ʵ���С�ڿ�ʼ����1molA��1molB����ƽ��ʱA�����ʵ�����
C�������٢����¶���ͬ��ƽ�ⳣ����ͬ����Ӧ�������У�
A��g��+B��g��?C��g��+D��g��
��ʼ��mol����1 4 0 0
�仯��mol����0.8 0.8 0.8 0.8
ƽ�⣨mol����0.2 3.2 0.8 0.8
��ƽ�ⳣ��K=$\frac{c��C{O}_{2}������{H}_{2}��}{c��CO��•c��{H}_{2}O��}$=$\frac{0.8��0.8}{0.2��3.2}$=1��
����������Ũ����Ϊ$\frac{1��2}{1��1}$=2��K=1����Ӧ���淴Ӧ���н���ƽ�⣬����������
D������C�з�����֪����Ӧ���淴Ӧ���У��ʿ����жϿ�ʼʱv��B��������v��B��������
��� �⣺A��ƽ��ʱ�ų�������Ϊ32.8 kJ���ʲμӷ�Ӧ��A�����ʵ���$\frac{32.8KJ}{41kJ}$��1mol=0.8mol����v��A��=$\frac{\frac{0.8mol}{2L}}{10min}$=0.04mol/��L��min������A��ȷ��
B�������ڵ�ЧΪ��ʼ����1molA��1molBƽ����ټ���3molD��ƽ��ʱA�����ʵ������ڿ�ʼ����1molA��1molB����ƽ��ʱA�����ʵ������������ٵ�ЧΪ��ʼ����1molA��1molB����ƽ����ټ���3molB��ƽ��ʱA�����ʵ���С�ڿ�ʼ����1molA��1molB����ƽ��ʱA�����ʵ�������ƽ��ʱA�����ʵ����������٣������ڣ����ڷ�Ӧǰ����������ʵ������䣬��ƽ��ʱ�����١����л�����������ʵ�����Ϊ5mol����ƽ��ʱA����������������٣������ڣ���B����
C�������٢����¶���ͬ��ƽ�ⳣ����ͬ����Ӧ�������У�
A��g��+B��g��?C��g��+D��g��
��ʼ��mol����1 4 0 0
�仯��mol����0.8 0.8 0.8 0.8
ƽ�⣨mol����0.2 3.2 0.8 0.8
��ƽ�ⳣ��K=$\frac{c��C{O}_{2}������{H}_{2}��}{c��CO��•c��{H}_{2}O��}$=$\frac{0.8��0.8}{0.2��3.2}$=1��
����������Ũ����Ϊ$\frac{1��2}{1��1}$=2��K=1����Ӧ���淴Ӧ���н���ƽ�⣬�����������ʢ۴�ƽ��ʱ��ϵ�����ı仯��ҪΪ����ת��Ϊ��ѧ�ܣ���C��ȷ��
D������C�з�����֪����Ӧ���淴Ӧ���У��ʿ����жϿ�ʼʱv��B��������v��B����������D��ȷ��
��ѡ��C��
���� ���⿼�黯ѧƽ���йؼ��㡢��ѧƽ��Ӱ�����ء�ƽ�ⳣ��Ӧ�õȣ�Bѡ���������ƽ�ⳣ�����㣬���ȽϷ�����ע�����õ�Ч˼���𣬹ؼ��ǵ�Чƽ��;���Ľ������Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | -1528.6kJ/mol | B�� | -1473kJ/mol | C�� | +1473kJ/mol | D�� | +1528.6kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
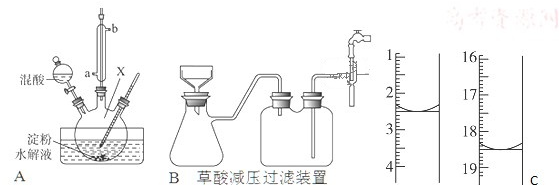
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
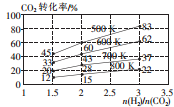 ������̼���������ЧӦ����Ҫ���壬������̼�Ļ����������Ǽ�������ЧӦ����Ч;��֮һ��
������̼���������ЧӦ����Ҫ���壬������̼�Ļ����������Ǽ�������ЧӦ����Ч;��֮һ��| �¶�/K CO2ת����/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��B
��B ��C
��C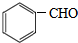 ��F
��F ��
�� $��_{��}^{ŨH_{2}SO_{4}}$
$��_{��}^{ŨH_{2}SO_{4}}$ +2H2O��
+2H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ����a����Ҫ�ɷ���BaS04��BaC03 | |
| B�� | ��Һb��Na+�����ʵ���Ϊ0.08 mol | |
| C�� | ����d�ڱ�״���µ����Ϊ224 mL | |
| D�� | ԭ�������Na2S04��Na2C03�����ʵ���֮��Ϊ1��3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com