
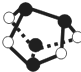
 NA表示阿伏加德罗常数的值,下列说法正确的是( )
NA表示阿伏加德罗常数的值,下列说法正确的是( )| A、0.5mol雄黄(As4S4结构如图)含有NA个S-S键 | ||||
| B、7.8g Na2S和7.8g Na2O2中含有的阴离子数目均为0.1NA | ||||
C、1.8g
| ||||
| D、氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L |
16 8 |
| 1.8g |
| 32g/mol |
18 8 |
| 1.8g |
| 54g/mol |
16 8 |
| 1.8g |
| 32g/mol |
18 8 |
| 1.8g |
| 54g/mol |


科目:高中化学 来源: 题型:
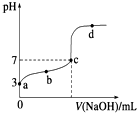 常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
常温下下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )| A、a点表示的溶液中c(CH3COO-)等于10-3mol?L-1 |
| B、b点表示的溶液中c(CH3COO-)>c(Na+) |
| C、c点表示的溶液中c(CH3COO-)=c(Na+) |
| D、d点表示的溶液中c(Na+)>c(CH3COO->c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示.下列说法正确的是( )| A、铁是阳极,电极反应为Fe-2e-+2OH-═Fe(OH)2 |
| B、电解一段时间后,镍电极附近溶液的pH减小 |
| C、若离子交换膜为阴离子交换膜,则电解过程中氢氧根向阳极移动 |
| D、每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若有机物A是由异戊二烯(C5H8)和丙烯酸(C3H4O2)加热得到的,则该反应的反应类型属于加成反应 |
| B、有机物D分子中所有碳原子一定共面 |
| C、有机物C 的所有同分异构体中不可有芳香族化合物存在 |
| D、有机物B 既能跟Na反应放出H2,又能跟NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“地沟油”禁止食用,但可用于制造生物柴油 |
| B、“PM2.5”是指大气中直径小于或等于2.5μm(1μm=1×10-6m)的颗粒,“PM2.5”与空气形成的分散系属于胶体 |
| C、红宝石、水晶、玻璃、陶瓷等都是硅酸盐制品 |
| D、分馏、裂化、裂解是利用化学变化来炼制加工石油的三种重要方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B、大型制冷设备的液氨大量泄漏不会对操作人员造成伤害 |
| C、Al(SO4)3可用于对自来水进行杀菌消毒 |
| D、静电除尘与胶体的基本性质有一定联系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | ||||
B、铜片接电源正极,碳棒接电源负极,电解硫酸铜溶液:Cu+2H+
| ||||
| C、在100mL浓度为1mol?L-1的Fe(NO3)3的溶液中通入足量SO2 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | ||||
| D、实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O═4Fe3++4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6句 | B、7句 | C、8句 | D、9句 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com