
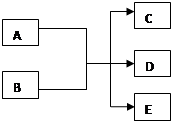
 在一定条件下,某些化学反应可以如图框架表示(未注明反应条件),根据要求回答下列问题:
在一定条件下,某些化学反应可以如图框架表示(未注明反应条件),根据要求回答下列问题:分析 (1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,说明发生了氧化还原反应中的歧化反应,所以推断A为Cl2,B为NaOH,D具有漂白性,判断D为次氯酸钠,C为氯化钠,E为水;
(2)若A为氧化物,C、D中有一种是常见的有毒气体单质,应是实验室用二氧化锰与浓盐酸制备氯气的反应;
(3)若A为红色金属单质判断为Cu,B为某种非金属元素的最高价氧化物的水化物的稀溶液,能和铜反应证明是稀硝酸;
(4)若C、D均为气体且均能使澄清石灰水变浑浊,判断气体为二氧化碳和二氧化硫,则判断AB为碳和浓硫酸的反应;
(5)若A、B都为固体,C为气体,D是常用的干燥剂,则判断为用氯化铵与碱石灰反应制氨气,D为碱石灰,据此答题.
解答 解:(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,说明发生了氧化还原反应中的歧化反应,所以推断A为Cl2,B为NaOH,D具有漂白性,判断D为次氯酸钠,C为氯化钠,E为水;反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)若A为氧化物,C、D中有一种是常见的有毒气体单质,应是实验室用二氧化锰与浓盐酸制备氯气的反应,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)A为红色金属单质判断为Cu,B为第二周期某种元素的最高价氧化物的水化物的稀溶液,能和铜反应证明是稀硝酸;铜与稀硝酸的反应离子方程式为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)若C、D均为气体且均能使澄清石灰水变浑浊,判断气体为二氧化碳和二氧化硫,符合上述框图要求的化学方程式为碳和浓硫酸加热的反应,反应化学方程式为:
则判断AB为碳和浓硫酸的反应,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H2O.
(5)若A、B都为固体,C为气体,D是常用的干燥剂,则判断为用氯化铵与碱石灰反应制氨气,D为碱石灰,反应方程式为NH4Cl+NaOH=NH3+NaCl+H2O,
故答案为:NH4Cl+NaOH=NH3+NaCl+H2O.
点评 本题考查了物质转化关系的应用,物质性质的综合推断,明确氯及其化合物、碳、浓硫酸、稀硝酸等物质的特征反应来推断物质是解答本题的关键,并熟悉离子方程式的书写等化学用语的应用即可解答,题目难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NO3-、K+、SO42- | B. | Cu2+、Ba2+、SO42-、CO32- | ||
| C. | OH-、Cl-、NH4-、Na+ | D. | Mg2+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 升高温度 | 逆反应速率增大量大于正反应速率增大量 | Z的体积分数变大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜丝在空气中灼烧后迅速伸入乙醇蒸气中 | |
| B. | 铁粉与硫粉物质的量之比为1:1时混合加热 | |
| C. | 锌粉加入到氯化铜溶液中 | |
| D. | 去除氧化膜的铝条插入到浓硝酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量递增,量变引起质变 | |
| B. | 元素原子核外电子排布呈周期性变化 | |
| C. | 元素的原子半径由大到小变化 | |
| D. | 元素的化合价呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙炔属于混合物 | B. | 聚乙炔的分子中不含有碳碳叁键 | ||
| C. | 聚乙炔的相对分子质量为26 | D. | 聚乙炔中碳的质量分数为92.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有3.6amolHNO3的稀溶液中,加入amolFe粉,反应的离子方程式为5 Fe+4NO3-+16H+=4NO+2Fe3++8H2O+3Fe2+ | |
| B. | 碳酸钠溶液中通入氯气,得到三种钠盐,则反应的离子方程式为Cl2+H2O+2CO32-=ClO-+Cl-+2HCO3- | |
| C. |  分子中所有原子共平面 分子中所有原子共平面 | |
| D. | 肌醇  与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 与葡萄糖的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,二者均属于糖类化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com