

| c(标准)×V(标准) |
| V(待测0 |
| c(标准)×V(标准) |
| V(待测0 |
| V |
| 10 |
| aV |
| 10 |
| 1.008g |
| 1.2g |


科目:高中化学 来源: 题型:

| 实验记录 | 实验分析或实验结论 | |
| 现象 | 硬质玻璃管内物质由绿色变为红棕色 | 说明生成的物质有 |
| 干燥管内物质颜色由白色变为 | 说明生成的物质有 | |
数据 | 称取绿矾样品质量11.12g | |
| C装置增重1.28g | 说明生成SO2 | |
| A装置中生成白色沉淀4.66g | 说明生成SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.1 mol?L-1碳酸钠溶液中的阴离子总数为0.1NA |
| B、将400 mL 1 mol/L的HNO3溶液与7 g Fe粉充分反应,转移电子数为0.375NA |
| C、标准状况下,14 g氮气中共用电子对的数目为1.5NA |
| D、已知反应N2(g)+3H2(g)?2NH3(g)△H=-91.8KJ/mol中反应物的转化率为30%,相同条件下,当放出91.8 kJ热量时,生成氨分子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
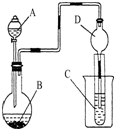
| A、若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B、若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊 |
| C、实验仪器D主要起到洗气的作用 |
| D、若A为浓氨水,B为生石灰,C中AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强碱性溶液中:Na+、CO32-、SO32-、K+ |
| B、石蕊呈红色的溶液:ClO-、Na+、SO32-、Cl- |
| C、PH>7的溶液中:Mg2+、Br-、K+、Al3+ |
| D、加入Fe能放出H2的溶液中:Cl-、Mg2+、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com