
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
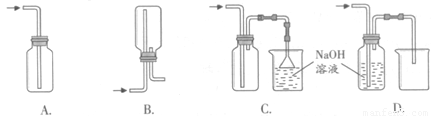
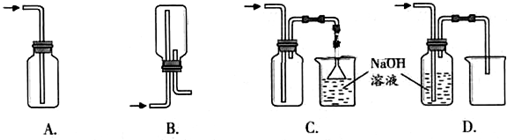
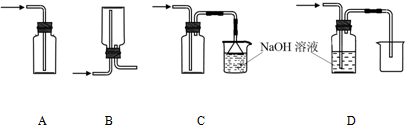
①下列收集Cl2的正确装置是 。
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 。
(2)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
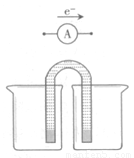
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极。
(1)①C(2分)
②Cl2、HClO、ClO-(3分)
③加入足量或适量NaBr溶液,振荡、静置,溶液分层,下层液体为橙色,说明氧化性:Cl2> Br2(3分,其他合理说法也给分)
(2)①(3分,下列三种图像或其他合理画法均给分)

②表面变黑,失去金属光泽,被腐蚀或被氧化(1分,其他合理答案也给分)
③原电池甲或甲(1分) 有盐桥存在时,负极金属锌和硫酸铜(或铁和硫酸铜)没有直接接触,两者不会直接发生置换反应,化学能不会转化为热能,几乎全部转化为电能(或无盐桥时,负极金属锌和硫酸铜(或铁和硫酸铜)直接接触,两者能直接发生置换反应,化学能部分转化为电能,部分转化为热能,3分,其他合理解释也可得分)
(3)锌片(或Zn)(1分)
【解析】
(1)①集气瓶中使用单孔橡胶塞紧,只能进气,不能排气,则瓶内气体压强增大到一定程度,可能爆炸等,A项错误;倒立的集气瓶中有双孔橡胶塞,由于氯气的密度比空气大,氯气从长导管中进,不会排出瓶内上部的空气,而是直接沉底,从短导气管中逸出,因此不能排出空气收集氯气,B项错误;正立的集气瓶中有双孔橡胶塞,由于氯气的密度比空气大,氯气从长导管中进,先沉底并将底部空气排出,短导气管排出的气体通过倒扣漏斗、NaOH溶液吸收处理,既防止倒吸又防止污染空气,C项正确;氯气与NaOH溶液能反应,即Cl2+2NaOH=NaClO+NaCl+H2O,因此不能用排NaOH溶液的方法收集氯气,D项错误;②氯气与水发生可逆反应,生成盐酸和次氯酸,即Cl2+H2O H++Cl-+HClO,所得氯水中含有三种分子四种离子,即H2O、Cl2、H+、Cl-、HClO、ClO-、OH-,其中具有强氧化性的含氯粒子是Cl2、HClO、ClO-;③Cl2、Br2都是卤素单质,都是非金属单质,比较非金属单质氧化性强弱时,通过氯气与溴化钠溶液能否发生在置换反应、反应后四氯化碳层是否是橙色,可以判断氯气和溴单质的氧化性强弱,即设计的实验方案为:取少量新制氯水和CCl4于试管中,滴入足量或适量NaBr(或KBr、HBr)溶液,振荡、静置,溶液分层,下层液体是橙色,说明氯气与溴化钠(或KBr、HBr)溶液发生置换反应或Cl2+2NaBr=2NaCl+Br2(或Cl2+2KBr=2KCl+Br2、Cl2+2HBr=2HCl+Br2),四氯化碳将生成的溴从水层萃取到下层,下层呈橙色,氯元素由0价将为—1价,溴元素由—1价降为0价,则Cl2是氧化剂,Br2是氧化产物,由于氧化剂的氧化性比氧化产物强,则氧化性:Cl2> Br2;
H++Cl-+HClO,所得氯水中含有三种分子四种离子,即H2O、Cl2、H+、Cl-、HClO、ClO-、OH-,其中具有强氧化性的含氯粒子是Cl2、HClO、ClO-;③Cl2、Br2都是卤素单质,都是非金属单质,比较非金属单质氧化性强弱时,通过氯气与溴化钠溶液能否发生在置换反应、反应后四氯化碳层是否是橙色,可以判断氯气和溴单质的氧化性强弱,即设计的实验方案为:取少量新制氯水和CCl4于试管中,滴入足量或适量NaBr(或KBr、HBr)溶液,振荡、静置,溶液分层,下层液体是橙色,说明氯气与溴化钠(或KBr、HBr)溶液发生置换反应或Cl2+2NaBr=2NaCl+Br2(或Cl2+2KBr=2KCl+Br2、Cl2+2HBr=2HCl+Br2),四氯化碳将生成的溴从水层萃取到下层,下层呈橙色,氯元素由0价将为—1价,溴元素由—1价降为0价,则Cl2是氧化剂,Br2是氧化产物,由于氧化剂的氧化性比氧化产物强,则氧化性:Cl2> Br2;
(2)①根据题给条件和原电池的构成条件可得,带盐桥的原电池甲可以设计锌铜原电池(或铁铜原电池、锌铁原电池),由于外电路中电子从左移向右,说明左边烧杯中电极的金属活动性较强,则左、右两边烧杯中电极材料及电解质溶液可以为锌片和硫酸锌溶液、铜片和硫酸铜溶液(或者铁片和硫酸亚铁、铜片和硫酸铜溶液,锌片和硫酸锌溶液、铁片和硫酸亚铁溶液);②由于金属活动性:Zn>Fe>Cu,则原电池乙中铜片作正极,锌片或铁片作负极,工作一段时间后,负极金属锌或铁本身被腐蚀或被氧化,表面变黑,失去金属光泽,质量减轻,溶液中蓝色变浅;③甲、乙两种原电池都能将化学能转化为电能,其中带有盐桥的原电池甲中的负极金属锌和硫酸铜(或铁和硫酸铜)没有直接接触,二者不会直接发生置换反应,化学能不会转化为热能,几乎全部转化为电能;而原电池乙中的负极金属锌和硫酸铜(或铁和硫酸铜)直接接触,两者会直接发生置换反应,部分化学能会转化为热能,化学能不可能全部转化为电能【或无盐桥时,负极金属锌和硫酸铜(或铁和硫酸铜)直接接触,两者能直接发生置换反应而放热,化学能部分变为电能,部分变为热能】;
(3)由牺牲阳极的阴极保护法可得,铁片作正极(阴极)时被保护,而铁作负极(阳极)时被腐蚀,为了减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选择比铁活泼的锌片作负极(阳极),使铁片作正极(阴极),从而牺牲锌片保护铁片;不能选择铜片,因为铜作正极(阴极),而铁片作负极(阳极),此时铁片的腐蚀速率加快,而不是延缓。
【考点定位】本题以元素化合物性质和实验知识为载体,考查考生对常见元素的单质和重要化合物的主要性质的掌握程度;考查考生气体收集方法、尾气处理装置的掌握情况;考查考生基本的实验操作技能和初步设计实验的能力以及分析、解决问题的能力;考查考生的创新能力和思维方法;考查考生对原电池构成条件和工作原理的理解程度,以及用图形正确表达分析结果的能力;考查考生对原电池负极反应现象的观察能力及其实验现象的表达能力;考查考生对有无盐桥对原电池中化学能转化为电能效率的评价及分析能力;考查考生对金属电化学防护的的理解;考查考生对元素化合物知识的综合应用能力;


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com