
下列叙述不正确的是
A.0.1 mol•L-1氨水中,c(OH-)>c(NH4+)
B.等体积等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
C.在0.1 mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol•L-1某二元弱酸强碱盐Na2A溶液中,c(Na+)=2c(A2-)+2c(HA-)+2c(H2A)
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2016届江苏省高三上学期第二次质检化学试卷(解析版) 题型:填空题
目前正在研究和已经使用的储氢合金有镁系合金、稀土系合金等。
(1)工业上用电解熔融的无水氯化镁获得镁。其中氯化镁晶体脱水是关键工艺之一,一种氯化镁晶体脱水的方法是:先将MgCl2·6H2O转化为MgCl2·NH4C1·nNH3(铵镁复盐),然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为 ____________。
(2)储氢材料Mg(AlH4)2在110~200℃的反应为:Mg(AlH4)2=MgH2+2Al+3H2↑。生成2.7gAl时,产生的H2在标准状况下的体积为______________L。
(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①下图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由下图可知,下列说法正确的是_______________(填字母)。

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②下图为25℃和75℃时,Al-LiBH4复合材料[w(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。

从图中可知,25℃时Al-LiBH4复合材料中与水完全反应的物质是______________(填化学式)。
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:

①某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=_______________。
②一定条件下,下图装置可实现有机物的电化学储氢(忽略其它有机物)。生成目标产物的电极反应式为_______________。

查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于物质用途的叙述中不正确的是
A.Na2O2可用作呼吸面具中的供氧剂
B.在常温下可用铝制容器贮藏运输浓硫酸
C.Al(OH)3可作治疗胃酸过多的一种药剂
D.四氧化三铁俗称铁红,可用于作油漆、红色涂料
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省平度市高二上学期直升班抽考化学试卷(解析版) 题型:选择题
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为
A.H2+2OH--2e-=2H2O B.O2+4H++4e-=2H2O
C.H2-2e-=2H+ D.O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省雅安市高一上学期12月月考化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列物质所含原子数最多的是
A.0.8molCO2 B.标准状况下22.4LO2
C.3.6g水 D.含NA个NH3分子的氨气
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西省高二上诊断检测化学试卷(解析版) 题型:选择题
下图是电解CuCl2溶液的装置,其中c、d为石墨电极,则以下有关此电解池的判断正确的是( )

A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高三上12月月考化学试卷(解析版) 题型:选择题
如图所示,下列叙述正确的是
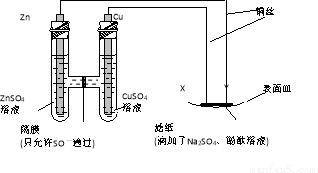
A. X为正极,发生氧化反应
B. Y为阴极,发生还原反应
C. X与滤纸接触处变红
D. Y与滤纸接触处有氧气生成
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:实验题
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电极的材料分别为石墨和铁。

(1)a极材料应为____________,电极反应式为____________________。
(2)电解液c可以是(填编号)__________。
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为_________________。在加入苯之前对c应做如何简单处理?___________________。
(4)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象是__________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北大名县一中高一上学期第二次月考化学试卷(解析版) 题型:选择题
某金属的硝酸盐受热分解生成NO2、O2和该金属的氧化物。已知NO2和O2的分子个数比为4:1,则在分解过程中该金属的化合价将
A.无法确定 B.升高 C.不变 D.降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com