
| 10-14 |
| 10-9 |
| 0.01mol/L×X-0.0001mol/L×Y |
| X+Y |
| 10-14 |
| 10-9 |
| 0.0001mol/L×Y-0.01mol/L×X |
| X+Y |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
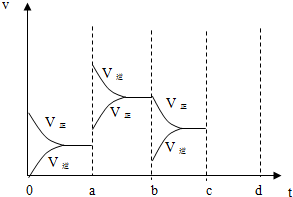
查看答案和解析>>
科目:高中化学 来源: 题型:
 80℃时,将0.40molN2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应:N2O4(g)?2NO2(g)△H>0,每隔一段时间对该容器内的物质进行分析,得到如下数据:
80℃时,将0.40molN2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应:N2O4(g)?2NO2(g)△H>0,每隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.04 | 0.28 | 0.20 | a | b | c |
| n(NO2) | 0.00 | 0.24 | 0.40 | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | 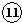 | |||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
 三种元素形成的气态氢化物最稳定的是
三种元素形成的气态氢化物最稳定的是查看答案和解析>>
科目:高中化学 来源: 题型:
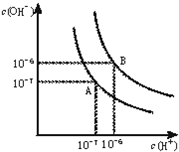 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 应称量NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com